RESEARCH研究概要
研究の背景
細胞内の異常タンパク質の蓄積は、様々な細胞機能障害を引き起こすため、タンパク質恒常性機構により認識され排除されることが、正常な細胞機能の維持に必要である。翻訳の正確性を向上させ異常タンパク質の産生を未然に防ぐことは、アルツハイマー病やパーキンソン病をはじめとする一連の神経変性疾患抑制の新規かつ有効なアプローチであると考えられる。我々は、異常タンパク質蓄積により引き起こされる疾患の理解と創薬の分子基盤を明らかにすることを目的に、異常蛋白質の産生を抑制する品質管理機構の分子機構を解析している。我々は、異常な翻訳を監視し異常タンパク質を合成途中で分解除去する翻訳品質管理機構RQC (Ribosome-associated quality control)を初めて発見した。近年その分子機構と生理機能の解明が急速に進み、タンパク質恒常性維持のごく初期段階として極めて重要な役割を果たすことが明確になってきている。翻訳の正確性を上昇させるようにリボソーム機能を亢進させ、かつ翻訳品質管理機構の活性を上昇することができれば、異常タンパク質の産生を未然に防ぎ健康寿命を延長させることが可能と考えられる。
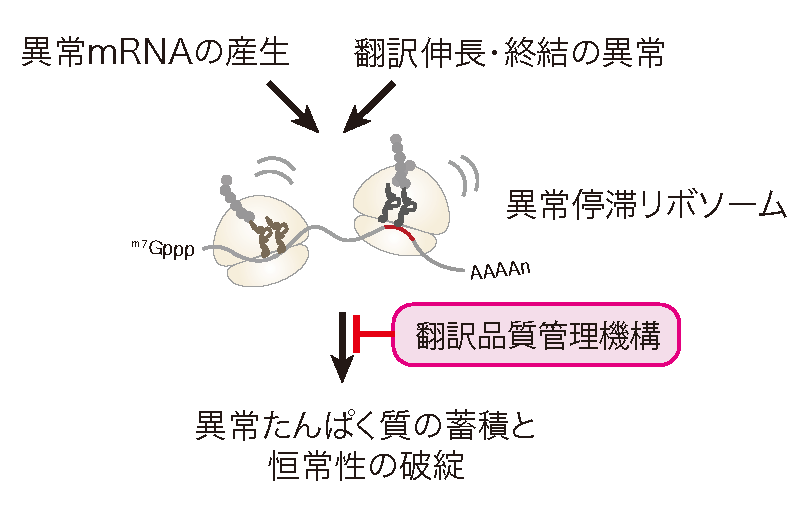
翻訳異常に対する品質管理RQCとNGDの分子機構
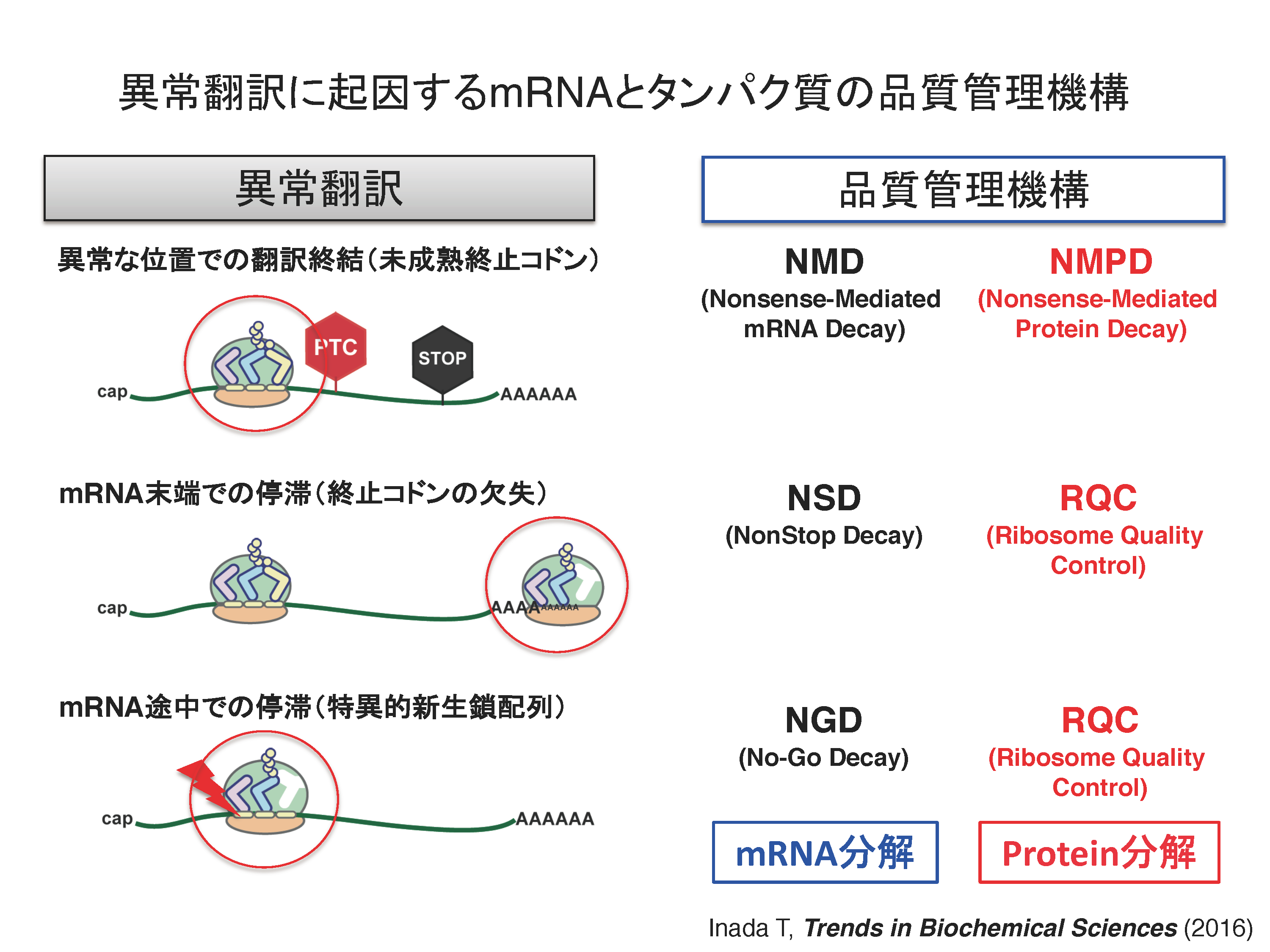
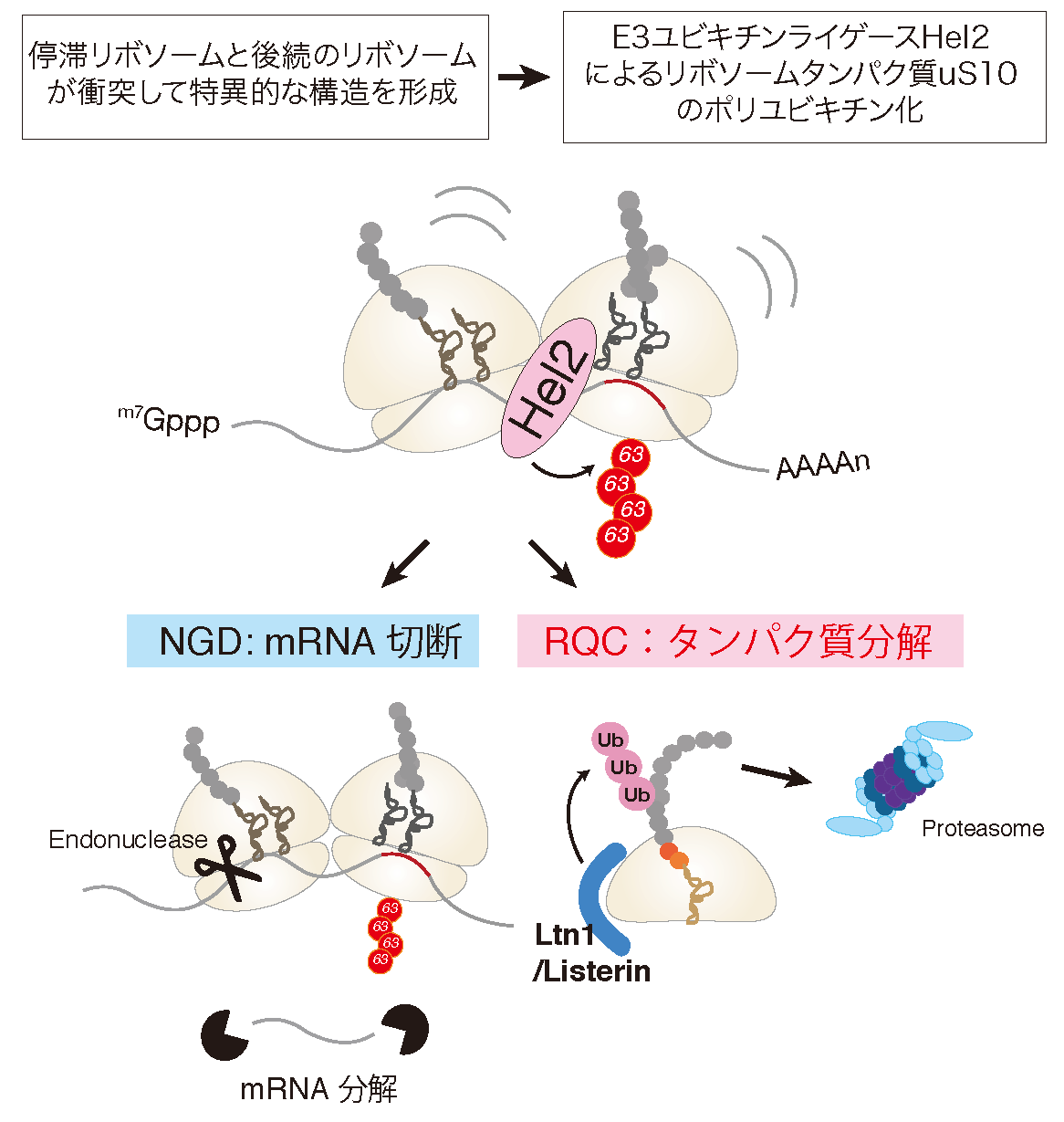
正確な遺伝子発現は生命現象の根幹であり、異常タンパク質の産生はタンパク質恒常性の破綻をもたらす根本原因と考えられる。異常タンパク質は、翻訳後に様々な要因で立体構造等の変化により生じるが、異常な mRNAや不正確な翻訳反応によっても生じることが明らかになってきた。異常な翻訳を認識し排除する品質管理機構によって、正確な翻訳反応が保証されると考えられてきたが、その実体は不明であった。我々は、異常翻訳により新生鎖のユビキチン化とプロテアソームによる迅速な分解が起こることを世界に先駆けて報告した(EMBO J.,2005; Genes Dev.,2007; JBC,2009)。我々の翻訳の正確性を保証する品質管理機構であるRQC(Ribosome-associated Quality Control)の発見以降、RQCがタンパク質恒常性維持のごく初期段階として極めて重要な役割を果たすことが明確になってきている(Inada, T. Trends in Biol. Sci., 2016)。我々は、RQCの初期段階である翻訳伸長中に停滞したリボソームを認識し解離させる分子機構を発見した(EMBO Rep., 2009, 2010; Mol. Cell, 2012; Cell Rep., 2012; Cell, 2012; JBC, 2014; JBC, 2015; Sci. Rep., 2016)。E3ユビキチンライゲース Hel2が翻訳伸長中に停滞したリボソームの特異的な構造を認識し、リボソームタンパク質ユビキチン化がRQCに必須であることを発見し、停滞した80Sリボソームを各サブユニットに解離する新規RQT2/3/4(RQC-Triggering factor 2/3/4)複合体を世界で初めて同定した(Nature Commun., 2017)。さらに、停滞したリボソームにより誘導される mRNA品質管理 NGD(No-Go Decay)にもE3ユビキチンライゲース Hel2が必須であること、Hel2が認識する停滞リボソームの特異的な構造を明らかにした(EMBO J., 2019)。
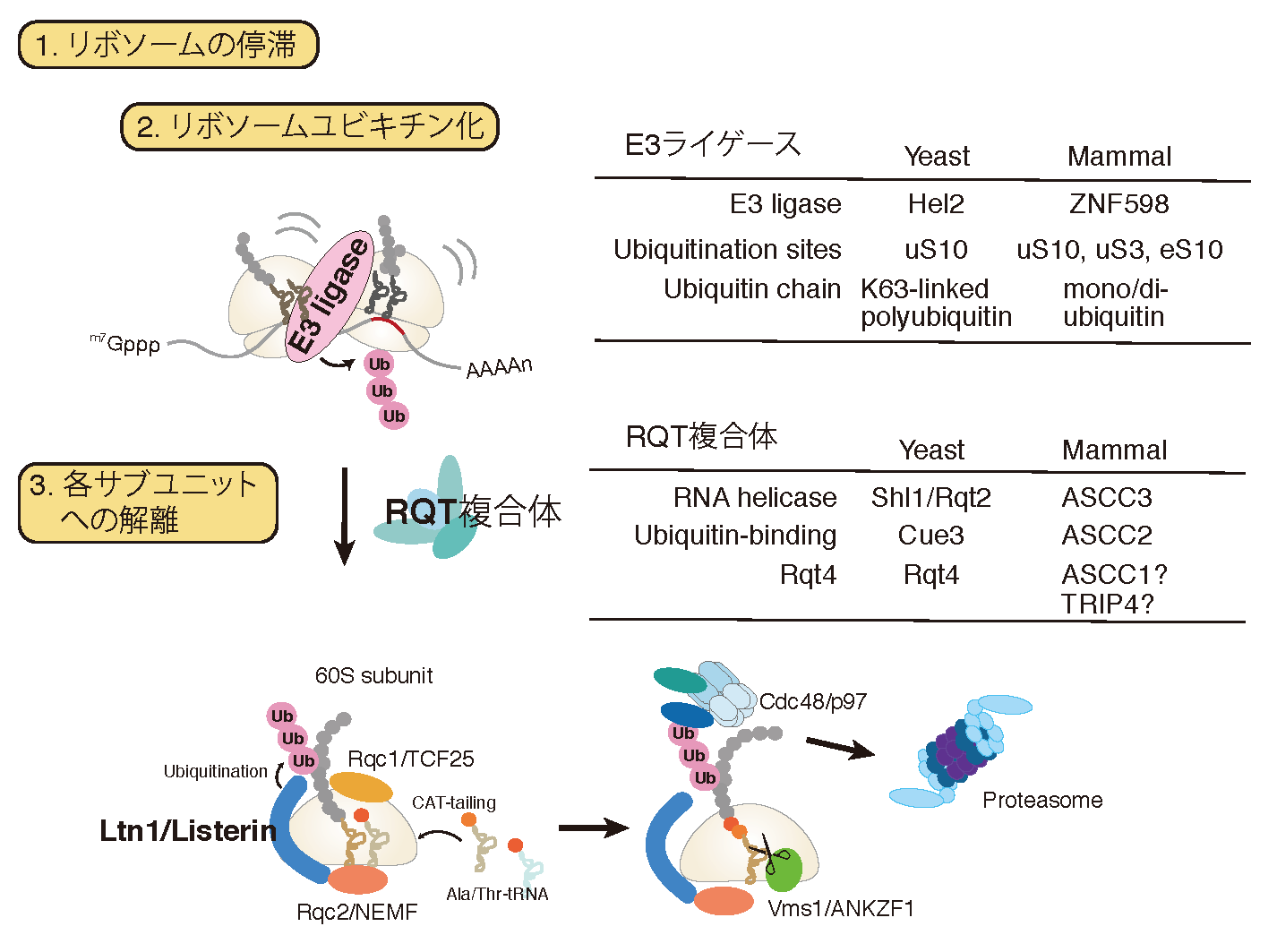
機能欠損リボソーム対する品質管理NRDの分子機構
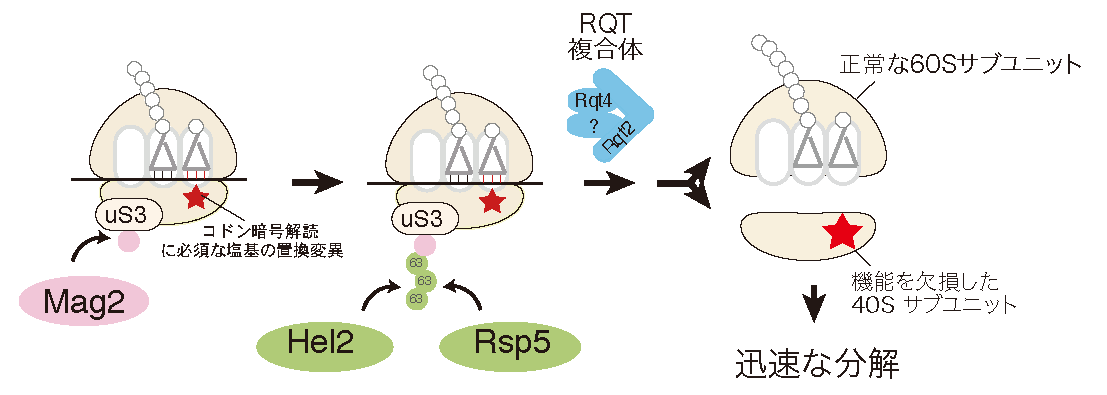
リボソームは、正確なコドン認識と高効率なペプチド結合を担うタンパク合成の中心装置であるだけでなく、様々な因子と相互作用し遺伝子発現に必須な機能を果たす。一方で、リボソーム合成は細胞のエネルギーの多くを消費し数百の因子が関与する、細胞内の主要な反応である。その合成途上で生じた異常リボソームは様々な発現異常の原因となるため、細胞は機能欠損リボソームを認識し排除する品質管理機構Nonfunctional Ribosomal RNA Decay(NRD)を保持している。我々は最近18S rRNA内の正確なコドン認識に必須な、全ての生物種で保存されている 塩基の置換変異によって機能を欠損したリボソームの品質管理を解析し、リボソームタンパク質uS3のK212残基のユビキチン化が必須であり、関与する E3 ユビキチンライゲースの同定に成功した(Cell Rep., 2019)。ユビキチン化された停滞した80Sリボソームは、RQT2によってを各サブユニットに解離されたのち、異常な40Sのみが分解されることも明らかにした。
ストレス応答におけるリボソーム動的修飾の機能
小胞体における分泌蛋白質の合成と修飾は細胞に必須である。小胞体内での異常蛋白質の蓄積は細胞に有害であるため、UPR経路を誘導することで応答する。出芽酵母では、小胞体ストレスにより活性化された膜蛋白質Ire1が、転写因子 Hac1の前駆体 mRNAをスプライシングし、Hac1が合成されてシャペロン等の転写が誘導される。高等真核生物でのでは、 PARKによってeIF2αがリン酸化され細胞全体の翻訳開始が抑制される。我々は、リボソームユビキチン化が、出芽酵母での小胞体ストレス時の翻訳制御に必須であることを見出した。
翻訳品質管理の生理機能とその異常による疾患
正確な遺伝子発現は生命現象の根幹であり、異常タンパク質の産生はタンパク質恒常性の破綻をもたらす根本原因である。翻訳の正確性を向上させ異常タンパク質の産生を未然に防ぐことは、アルツハイマー病やパーキンソン病をはじめとする一連の神経変性疾患抑制の新規かつ有効なアプローチである可能性がある。遺伝子発現の根幹であるタンパク質合成装置であるリボソーム機能の低下は、不良タンパク質の蓄積やオルガネラの損傷、シグナル伝達経路撹乱など、広範な細胞機能障害を引き起こすため、個体寿命の短縮の原因になると考えられる。しかしながら、リボソーム機能低下が細胞老化・個体機能低下を引き起こす過程はいまだ不明のままである。我々は、正確なコドン識別能を欠損したリボソームに対する品質管理機構NRD(Non-functional rRNA Decay)を解析し、機能欠損リボソームの認識・排除に必須なE3ユビキチンライゲースを発見した。リボソーム機能の異常を認識し排除するシステムの実体解明を基盤に、翻訳の正確性を向上される手法の開発を試みる。

