
疎水性アミノ酸残基が集中するC末端側領域が、脂質膜に対して高い親和性を示します。
アルツハイマー病は、認知機能障害と記憶力の低下を伴う進行性中枢神経変性疾患です。現在、世界で2600万人を超える患者がいると推定されており、予防法や根本的な治療法の開発が強く望まれています。 アルツハイマー病患者の脳に見られる病理学的特徴であるアミロイド斑は、約40アミノ酸残基からなるペプチドであるアミロイドβ(Aβ、図1)が分子間会合して生じた線維状凝集体(アミロイド線維)を主な成分とします。非会合状態のAβモノマーは無害ですが、分子間会合してオリゴマー化、または線維化したAβは培養細胞に対して毒性を示します。
 |
| 図1.Aβ1-40のアミノ酸配列 疎水性アミノ酸残基が集中するC末端側領域が、脂質膜に対して高い親和性を示します。 |
構造生物学的な観点からは、アルツハイマー病はタンパク質のコンホメーション変化を契機として引き起こされる「コンホメーション病」と総称される病気のひとつとして捉えることができます。即ち、Aβモノマーの水溶液中における構造は不規則ですが、分子間会合して線維となるためには、Aβはβシート構造を形成する必要があります。このため、Aβのコンホメーション変化の原因とメカニズムを理解することは、アルツハイマー病の予防法または根本的な治療法を開発する上で極めて重要です。
Aβ凝集の原因となる可能性が指摘されている生体成分として、細胞膜があります。細胞膜の外葉には、ガングリオシド、スフィンゴミエリン、およびコレステロールに富む脂質ラフトと呼ばれる膜ドメインが、周囲のグリセロリン脂質に富む膜から分離した状態で存在すると考えられています(図2、3)。近年、Aβが細胞膜の、特に脂質ラフトに集積して分子間会合することにより、アミロイド線維核(鋳型)を形成する可能性が多くの研究により示されています。 クロイツフェルト・ヤコブ病などの原因となるプリオンタンパク質の凝集も細胞膜の脂質ラフト(またはラフトと類似する脂質組成を持つ膜ドメインであるカベオラ)で生じると考えられていることから、脂質ラフトにはタンパク質の凝集や病原型構造への転移を促す性質があると思われます。
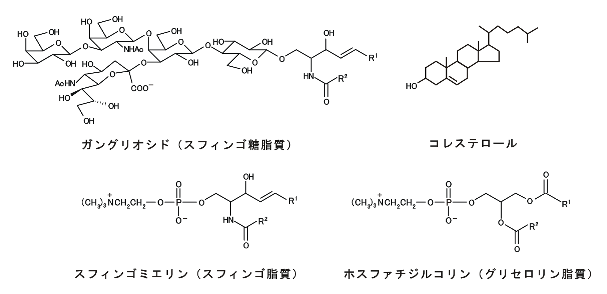 |
| 図2.脂質分子の構造 細胞膜を構成するスフィンゴ脂質の場合、アシル鎖(R)のほとんどは飽和炭化水素鎖であり、硬い膜を作りやすい。これに対して、グリセロリン脂質のアシル鎖は、一般にcis型の二重結合を含み、柔らかい膜を作る。 |
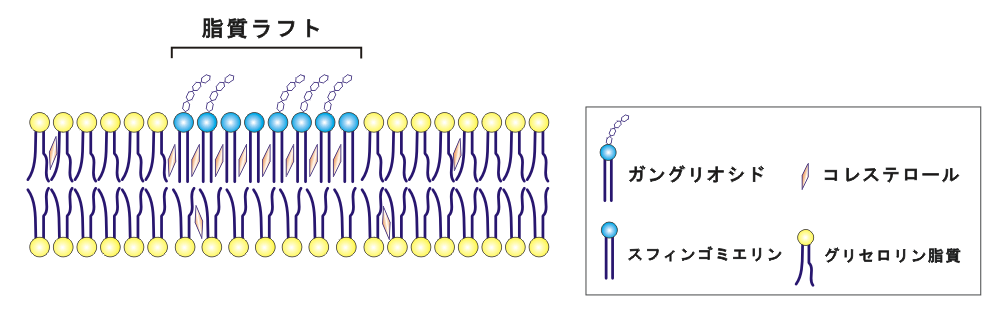 |
| 図3.脂質ラフト スフィンゴミエリンやコレステロールに富む脂質ラフトと呼ばれる膜ドメインが、周囲のグリセロリン脂質に富む膜から分離した状態で存在すると考えられている。ラフト内の脂質分子は、比較的密にパッキングされた、秩序高い状態になっている。 |
ラフト外の細胞膜は、アシル鎖中にシス型の二重結合を持つグリセロリン脂質を多く含むため、液晶相(無秩序液体相)の柔らかい膜であるのに対し、ラフト内は脂質分子のパッキングが密である秩序液体相と呼ばれる硬い膜の状態になっています。 当研究室では、膜の相状態の違いが、Aβのラフトへの集積および分子間会合の原因となる可能性に着目し、ペプチドと脂質膜の相互作用を種々の分光手法を用いて研究を行なっています。
細胞膜の主要な成分であるホスファチジルコリン(PC)の脂質二重膜は高温で液晶相であり、温度低下によりリップルゲル相を経てラメラゲル相に転移します(図4)。液晶相とリップルゲル相の間の相転移を主転移、リップルゲル相とラメラゲル相の間の相転移を前転移と呼びます。 Aβのチロシン残基の蛍光を利用して、AβとPC脂質二重膜の相互作用を調べたところ、Aβは液晶相とリップルゲル相のPC膜には結合しませんが、ラメラゲル相のPC膜に対しては結合することが分かりました(図4)。 ラメラゲル相でなければAβが結合しない理由は不明ですが、膜内で脂質分子が密にパッキングされている、またはリップルゲル相と比べて膜表面が滑らかである、というラメラゲル相の特徴が関係すると予想されます。 細胞膜はコレステロールを含むため、PCのみのモデル脂質膜が低温でとるようなゲル相の状態にはなりません。しかし、秩序液体相の状態にあると考えられる脂質ラフトにおいては、脂質分子は比較的高い流動性を保ちつつもラメラゲル相と同様に密にパッキングされていると考えられています。 膜を構成する脂質分子のパッキングがラフト内外で異なることが、細胞膜に結合したAβがラフトへ集積することの一因である可能性があります。
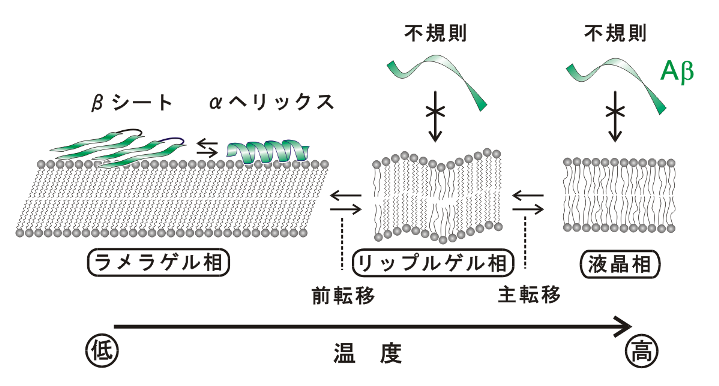 |
| 図4.Aβとホスファチジルコリン膜の相互作用 |
Aβと脂質二重膜(リポソーム)の混合溶液の円偏光二色性スペクトルを測定すると、膜に結合したAβの二次構造が分かります。 ラメラゲル相の中でも比較的高温の条件では、膜に結合したAβはモノマーでαヘリックスを形成します。 しかし、温度低下によりAβは膜結合状態で分子間会合し、βシートを形成することが分かりました(図4)。 前転移温度以下でラメラゲル相になったPC膜は、さらに冷却されると、より密なパッキングを持つ膜に段階的に変化し、最終的には結晶に近いパッキングを持つサブゲル相と呼ばれる状態に転移することが知られています。 Aβがαヘリックスを形成するか、または分子間会合してβシートを形成するかは、アルツハイマー病の発症を決定付けるかもしれない重要なポイントです。 脂質膜のパッキング状態の僅かな違いが、この分岐点において方向を決めるひとつの要素となっているのかもしれません。 脂質膜によるペプチドの二次構造制御メカニズムを解明するため、当研究室では、さらに研究を進めています。
アミロイドβ(Aβ1-40)ペプチドのアミロイド線維化がアルツハイマー病の原因となるのであれば、線維化阻害剤はアルツハイマー病治療薬となる可能性があります。 アミロイド線維形成は分子間βシート形成反応、すなわちペプチド主鎖間での水素結合形成反応です。 したがって、形成阻害剤に求められる条件は(i) Aβ1-40線維に対する親和性が高いこと、および(ii)分子間水素結合形成を効率的に阻害すること、です。これらの条件を満たす物質として、我々はAβ1-40の部分配列ペプチドAβ30-40[配列30AIIGLMVGGVV40]を選び、主鎖CONH基を数残基でメチル化する(CON(Me)基に置き換える)ことで阻害剤としての能力を解析しました。 線維形成を非常に効率よく阻害する物質を設計するための指針を得て、効果的な伸長阻害剤を作製することが本研究の目的です。
N-メチル化残基の異なる8種類のN-メチル化ペプチド(図5)100μMをAβ1-40 (50μM)に対し加えた結果、G37およびG38をメチル化した場合に線維形成量が約20%にまで低下すること、L34V36G38の3残基をメチル化したペプチドでは線維形成量が77%にしかならないこと、が明らかになりました。
N-メチル化残基を導入することにより水素結合形成を阻害することを意図しましたが、線維化阻害能とN-メチル化残基の数との間には相関が見られず、N-メチル化を行う残基は1残基で十分である、という結果を得ました。
円偏光二色性測定の結果から、N-メチル化ペプチドのスペクトルに現れる220 nmの負のピークが顕著である場合には線維化阻害能が小さく、顕著でない場合に阻害能が大きい、ということを見いだしました。
このピークの強度は、水溶液中でのN-メチル化ペプチドのコンフォメーションと関連すると考えられることから、N-メチル化ペプチドの水溶液中での構造が線維化阻害能に関連する可能性が示唆されます。
線維化阻害能の大小を決める要因に関して、現在さらに検討を進めています。
 |
| 図5.用いたN-メチル化Aβ30-40の配列 赤文字はN-メチル化残基を示す |