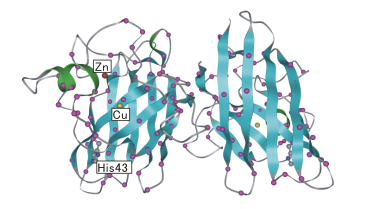
ALSで確認されている変異部位を紫色の点で示した
筋萎縮性側索硬化症 (ALS) は大脳、脊髄にある運動ニューロンが選択的に傷害される代表的な神経変性疾患であり、発症から数年で死に至る難病です。
しかし、発症原因および有効な治療法は現在でも確立されていません。
約20年前、一部の家族性ALS患者にCu,Zn-スーパーオキシドジスムターゼ (SOD1) というタンパク質をコードする遺伝子の異常が見つかり、以来、SOD1の変異とALSとの関連性が指摘されています。
しかし、変異SOD1がALSを引き起こす詳細なメカニズムは未だ不明です。
SOD1は1分子当たり1個のCuと1個のZnを含む2量体タンパク質です(図1)。
生体内ではスーパーオキシドを除去することにより、活性酸素毒性から生体を防御する役割を担っています。
 |
| 図1.SOD1の2量体構造 ALSで確認されている変異部位を紫色の点で示した |
当研究室では、大腸菌を用いて遺伝子組換えSOD1を作製し、SOD1の変異がその分子構造や酸化還元反応に与える影響を精査しています。 最近では、ALSに関連した変異体の一つである、43番目のヒスチジンがアルギニンに置き換わったHis43→Arg (H43R) SOD1は、野生型に比べ非常に構造不安定であること、また、その結果として変性してしまったH43R SOD1は、酸化促進作用を示すことを見出しました。 H43R SOD1における酸化促進性の増大は、細胞内に酸化ストレスをもたらし、ALS発症の要因となる可能性があります。 この様に、本研究成果がALS発症メカニズムの解明につながり、新規ALS治療薬開発の基礎となることを目指し、研究に取り組んでいます。
全身の血流には体循環と肺循環があります。
体循環血圧が高い状態が続く症状を高血圧症と呼ぶのに対し、肺循環の血圧が高い状態が続く症状を肺高血圧症と呼びます。
肺高血圧症に関連するペプチドホルモンのひとつエンドセリン1は、血管上皮の受容体に結合することで血管収縮を起こします。
この結果として血圧上昇が起こることから、受容体拮抗薬が肺高血圧症治療薬として今日用いられています。
エンドセリン1のアミノ酸配列(図2)には、21残基中に4残基のシステイン(Cys1-Cys15およびCys3-Cys11の2つのジスルフィド結合)が含まれるという特徴を持ちます。
X線およびNMR構造解析の結果、結晶中(図3左)および5%酢酸水溶液中(図3右)のいずれの状態でもN末端側(Cys1- Cys15)領域は2つのジスルフィド結合により固定され、Glu10- Phe14がヘリックス構造をとること、およびC末端側(His16-Trp21)領域の構造は結晶中と溶液中で異なること(各々ヘリックスと不規則構造)が明らかになっています。
各残基をアラニンで順次置換した変異体の生理活性(受容体結合能力および血管収縮能力)を測定したところ、ほとんどの残基のアラニン置換で受容体結合能力および血管収縮能力のいずれかが低下しました。
各残基が重要な役割を持つことが示唆されます。
これに対しHis16をAlaに置換した場合には、受容体結合能力および血管収縮能力ともに3倍以上上昇するという結果が得られました。
His16はET-1の生理活性を抑制していると思われます。
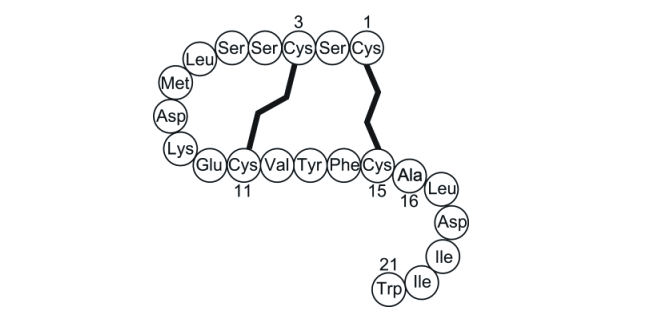 |
| 図2.エンドセリン1のアミノ酸配列 折れ線はジスルフィド結合を示す |
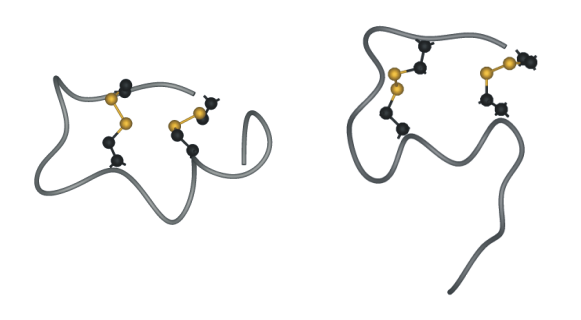 |
| 図3.結晶中(左、PDB: 1EDN)と水溶液中(右、PDB: 1V6R)のエンドセリン1の構造 |
His16はN末端側(構造の固定されたCys1-Cys15部分)とC末端側(構造の変化しうるHis16-Trp21部分)の境界にあることから、ET-1の全体的な立体構造形成に関与している可能性があります。我々は「なぜHis16が活性を抑制するか」を解明するために、エンドセリン1とH16A変異体に対して紫外ラマン分光法、可視ラマン分光法、赤外分光法、および円偏光二色性測定を利用して構造解析を行いました。
実験の結果、His16→Ala変異体の主鎖構造はWTに比べてpH条件による変化が大きい、という相違を見いだしました。
この主鎖構造変化はカルボキシル基(おそらくGlu10)のプロトン化によるものであり、WTにおいてはHis16の正電荷の作用により構造変化が抑制されるが、変異体の場合は抑制されない、という結果を得ました。
タンパク質構造のこのような相違点が、活性の大小に関与していると考えられます。
エンドセリンファミリー内でHis16がよく保存されていること、およびHis16のかわりにArg16を含む場合があることは、16番目の残基に正電荷が存在することの重要性を示唆します。
また計算機シミュレーションの結果から、エンドセリン1と受容体との結合にはHis16-Trp21領域の構造の柔軟さが重要であるという指摘があることも、我々の結論をサポートします。