Gタンパク質共役型受容体(GPCR)の機能解析
GPCRは細胞膜表面に存在する7回膜貫通型の受容体で、ホルモン, ペプチド, 生理活性アミンなど多種多様な細胞外の物質を感知するセンサーとして機能します。ヒトゲノムに存在する約800種のGPCRのうち、100種以上のGPCRが創薬標的となっており、これらのGPCRに対して500種近い治療薬が承認されています。これは現在承認されている薬の約3割を占め、GPCRは重要な創薬標的であると言えます。
私達の研究室では、シグナル分子の新規活性化検出法の開発や、シグナル分子の欠損細胞の樹立を通じて、GPCRの複雑な細胞内シグナル伝達機構を詳細に理解することを目指しています。これらの研究から、新たな創薬ターゲットを同定することや、より優れた治療薬を創出することが最終的な目標です。
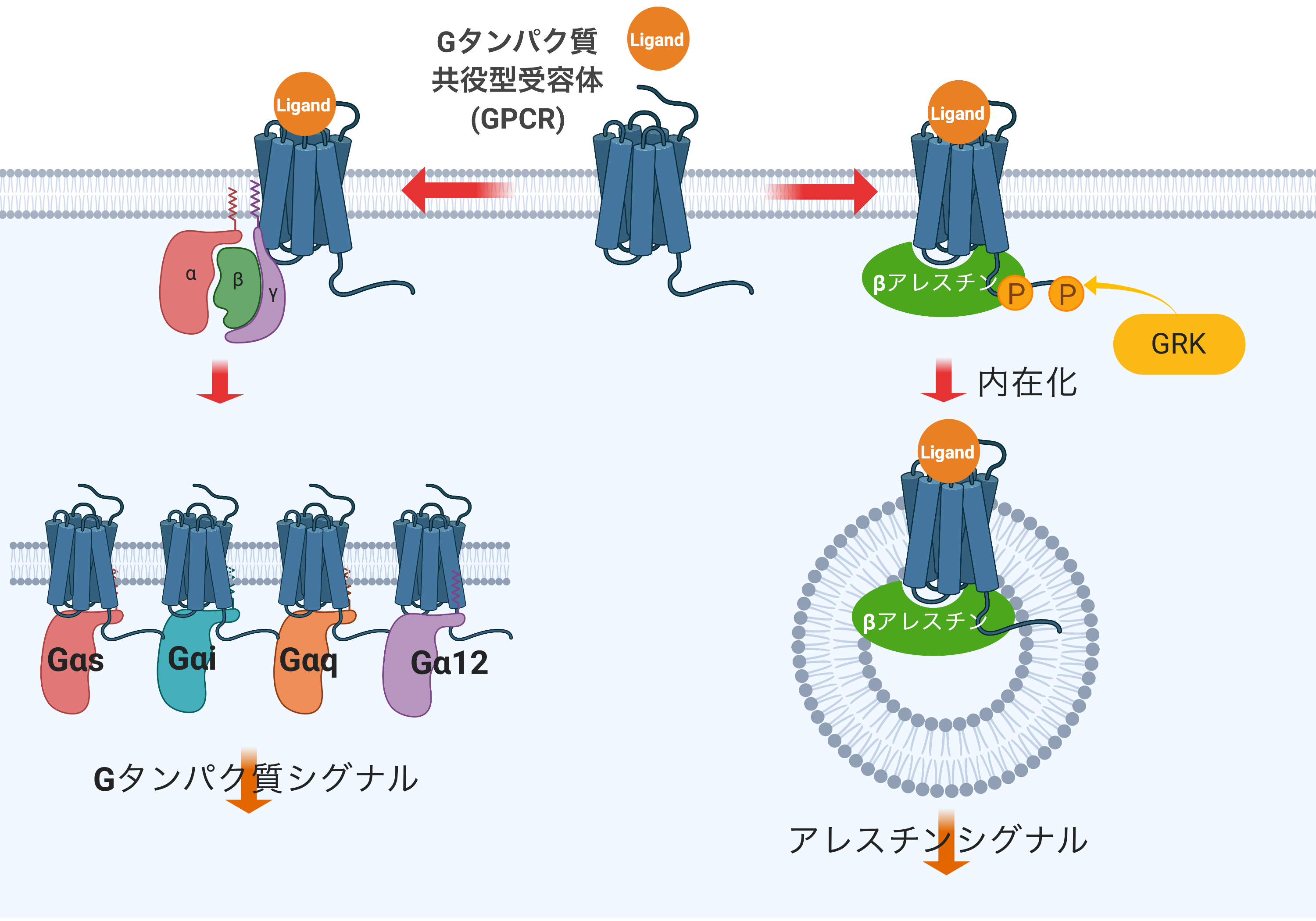
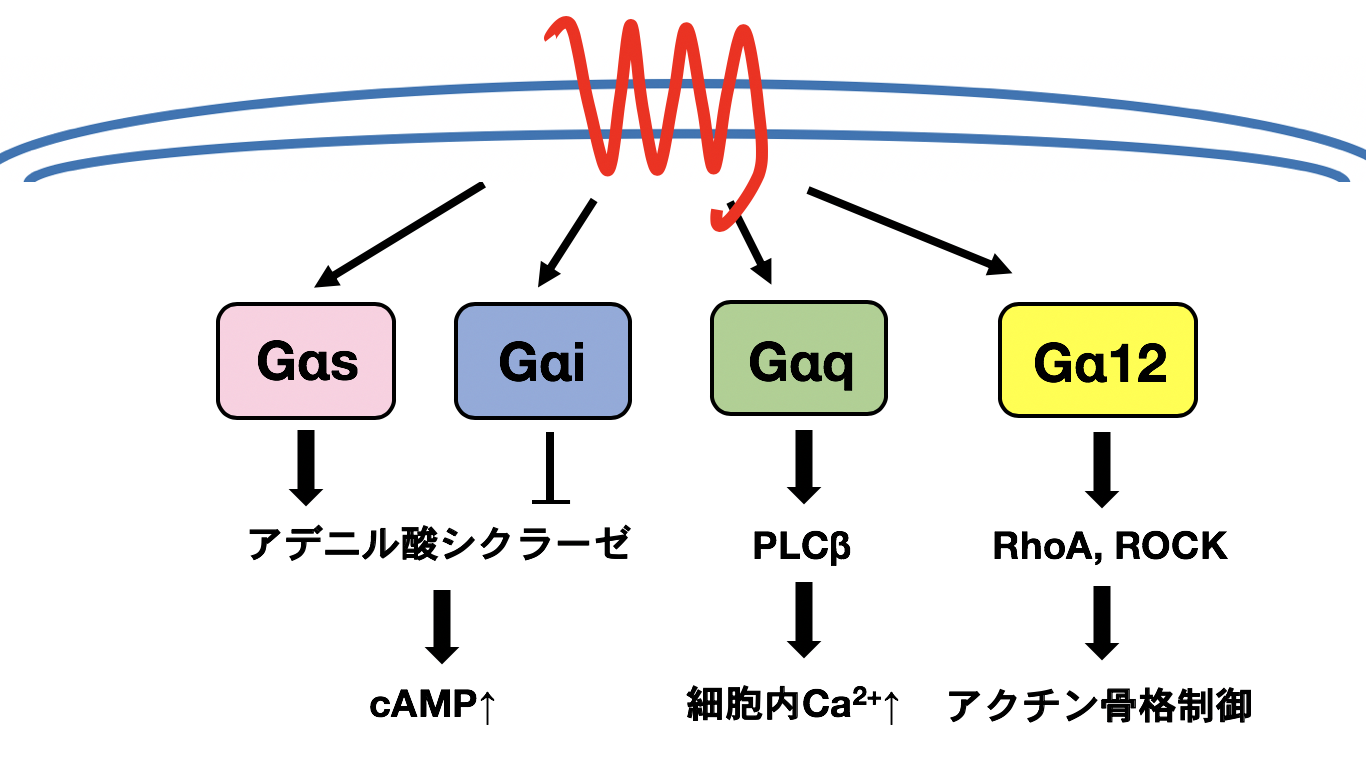
GPCRによって活性化される三量体Gタンパク質は、その機能からGs, Gi, Gq, G12に大別されます。このうちGs, Gi, Gqは古典的な三量体Gタンパク質であり、検出に適したセカンドメッセンジャーが存在することから活性化の測定が容易で、よく解析されています。一方、G12シグナルはアクチン骨格制御に働くことから、検出に適したセカンドメッセンジャーが誘導されず、活性化の測定が困難でした(図2)。
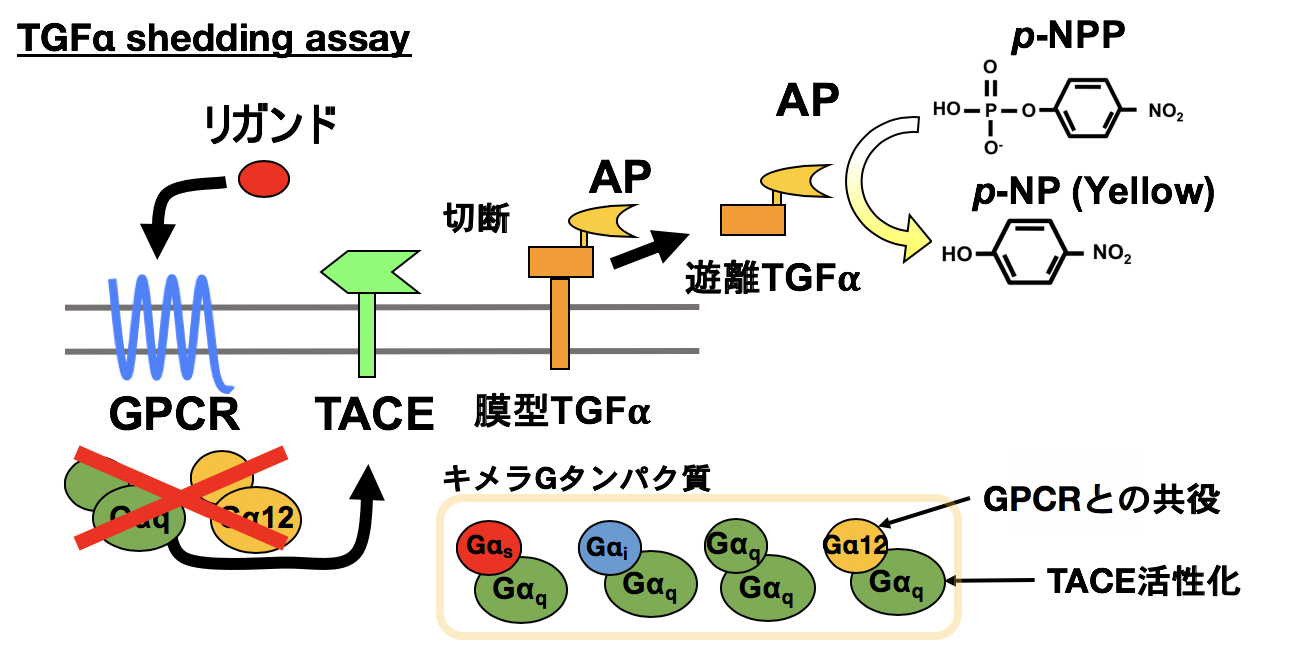
本研究室では、毛包におけるGPCRの機能解析の過程で、GqまたはG12シグナルの下流で細胞膜に存在するTGFαが切断され、細胞外に放出されることを見出しました。この反応を応用することで、ハイスループットかつ高感度にGqまたはG12の活性化を検出する実験系を確立しました。さらに、この実験系をCRISPR−Cas9法を用いて作製したGq, G12欠損細胞とキメラGαタンパク質を用いて改良することで、Gs, Gi, Gq, G12それぞれの活性化を同一プラットフォームで検出することが可能になりました(図3)。この実験系はTGFα切断アッセイと呼ばれ、国内外多数の研究室でGPCRの活性化検出法として利用されています(Inoue A et al., Nature Methods, 2012)。
また、本手法はGPCRのみならず、一部のイオンチャネルの活性化もまた検出することが可能であることを見出しており、広範な膜タンパク質の活性化検出に有用であることもわかっています。
※キメラGαタンパク質:三量体Gタンパク質αサブユニットのうち、GPCRとの結合に重要なC末端の6アミノ酸を別のαサブユニットのアミノ酸に置換したもの。固有の下流シグナルは維持し、GPCRとの共役を変化させることができる。
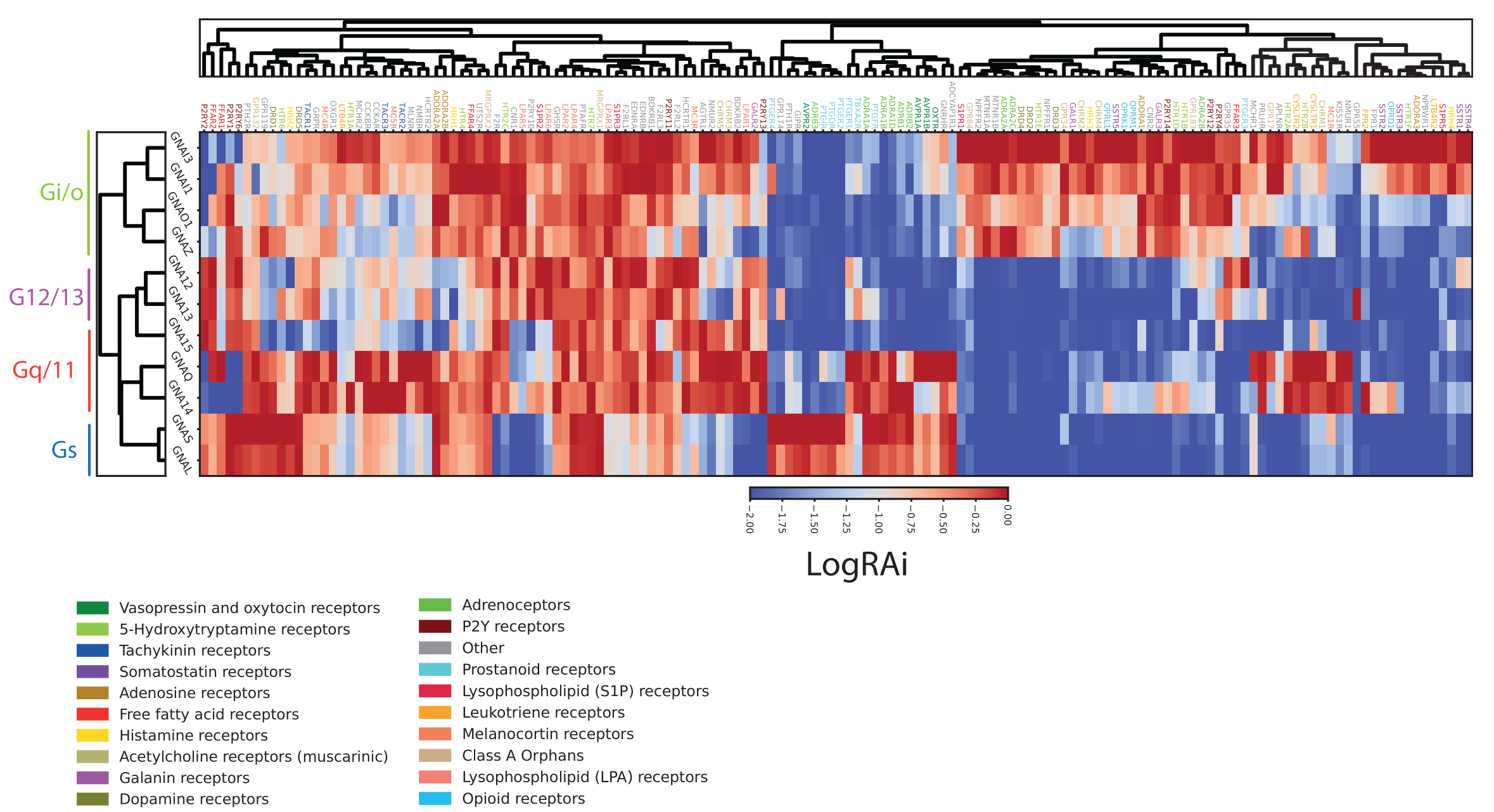
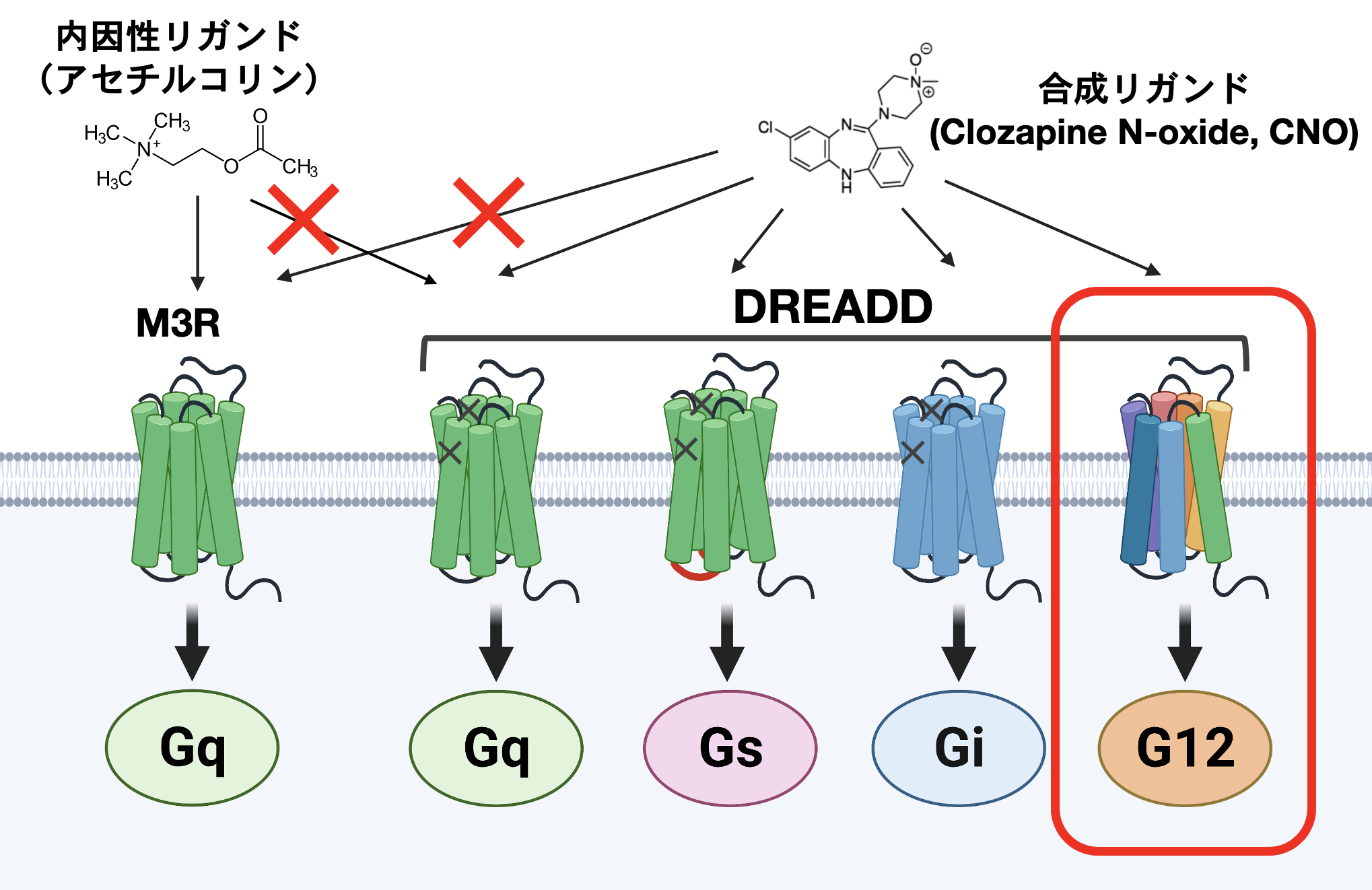
近年、デザイナーGPCRと呼ばれる人工GPCRがGPCRの機能解析において有用なツールとして着目されています。デザイナーGPCR は別名 DREADD(Designer Receptors Exclusively Activated by Designer Drug)と呼ばれ、内因性リガンドには応答せず、特定の人工リガンドにより活性化されます。汎用されているデザイナーGPCR とデザイナーリガンドはアセチルコリン受容体の改変体とCNO(クロザピン N-オキシド)です。 これまで、Gs, Gi, Gqのそれぞれに選択的に共役するDREADDが報告されていましたが、G12に共役するDREADDは報告されていませんでした。先に述べたPRECOGを用い、G12との共役を好むアミノ酸配列を探索し、Gq共役型のDREADDに導入することで、世界で初めてG12共役型DREADDを創出することに成功しました(Inoue A et al., Cell, 2019)。
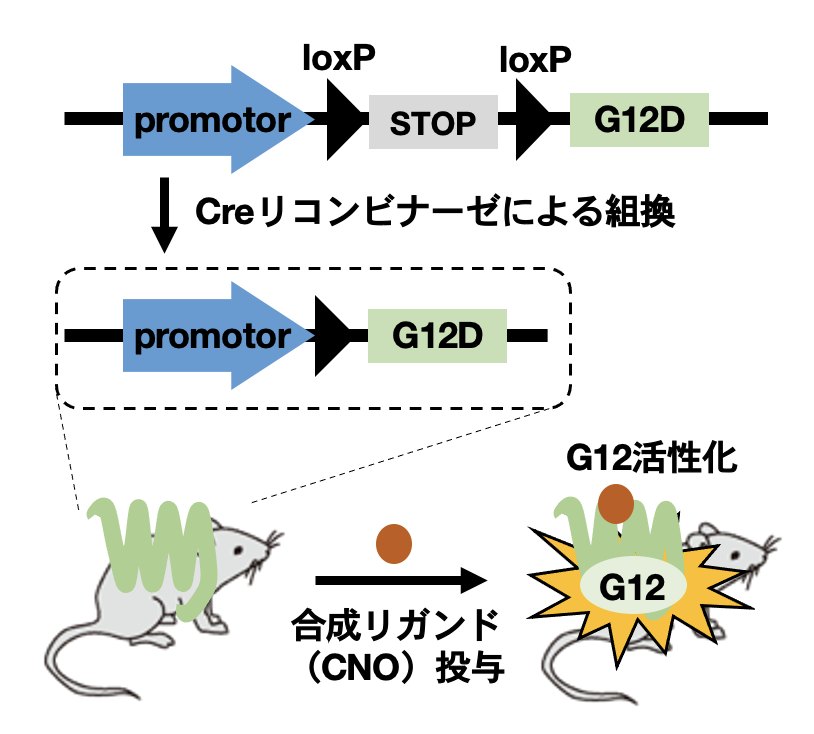
TGFα切断アッセイを用いて50種類以上のGPCRがG12に共役することを新たに見出しましたが、これらのGPCRのG12を介した機能はほとんどわかっていません。その理由として、G12 共役型 GPCR に対する有用な作動薬が存在せず、個体レベルの薬理学的な解析が困難であったことや、G12ファミリー(G12, G13)の欠損マウスは血管形成不全から胚性致死となることが挙げられます。前述したG12共役型DREADDは、個体レベルで合成リガンドの制御下でG12シグナルを活性化することができる研究ツールであり、この問題を克服することができます。当研究室ではG12共役型DREADDをCre recombinase依存的に発現するマウスを作製し、個体レベルでのG12の機能解析を進めています。
GPCRシグナルは、リガンドにより活性化した後、細胞内でダイナミックなシグナル伝達が生じます。これまでの解析方法では、あるタイムポイントでのシグナルの蓄積量で評価することが多く、継時的なシグナル分子の挙動を追跡することは困難でした。我々は、高輝度のスプリットルシフェラーぜである NanoBiT システムを用い、2種のタンパク質の相互作用を評価することで、
・タンパク質の解離(Gα、Gβγサブユニットの解離)
・Gαタンパク質とエフェクタータンパク質の結合
・GPCR-GRK、GPCR-βアレスチンの結合
等の継時的な変化を評価する方法を確立しています。
当研究室では、GPCRシグナル研究で汎用される HEK293細胞において、GPCR直下で機能するタンパク質を欠損させた細胞を作成し、研究に応用しています。具体的には、疾患の原因となる変異の機能解析や、複数のシグナルがどのように関与しあうか(シグナルクロストーク)の解析等に用いています。現在、上記の細胞パネルを所有しており、供与が可能となっています。
GPCRなどのタンパク質は、リガンドや基質といった他の分子と相互作用することによって立体構造変化を起こし、その形に応じた機能を発揮します。これまでに多くのGPCRの活性化状態・不活性化状態の立体構造が決定されてきましたが、不活性化状態にあるタンパク質がどのような構造変化の過程を経て活性化状態に至るのか、その引き金となるアミノ酸残基はどれなのか、という問題を静的なタンパク質の立体構造のみから解き明かすのは難しい問題です。そこで、分子動力学シミュレーションと呼ばれる手法を用いることでタンパク質の原子レベルでの動きを観察し、GPCRの動的な性質を解き明かそうとしています。

GPCRとエフェクターが「いつ」「どこで」「どのように」相互作用しているかは、細胞内シグナル伝達を理解する上で重要な問いです。我々は、生きた細胞においてGPCR-エフェクター分子の動きや会合状態、結合・解離を1分子レベルで計測できる蛍光顕微鏡システム[About SeikaへのLink]を開発し、シグナル伝達の空間的制御機構の解明に取り組んでいます。1分子を観ることで、同じ細胞膜中のGPCR分子にも「個性」があることが分かります。細胞は形質膜中にGPCRとエフェクター分子を集積させた作業場を構築することで、高効率な情報処理を実現していると予想されます。今後、リガンド刺激依存的なGPCR・エフェクター分子の動態変化を解析することで、GPCR標的薬の作用機序の解明につなげます。

