研究内容
研究テーマ1
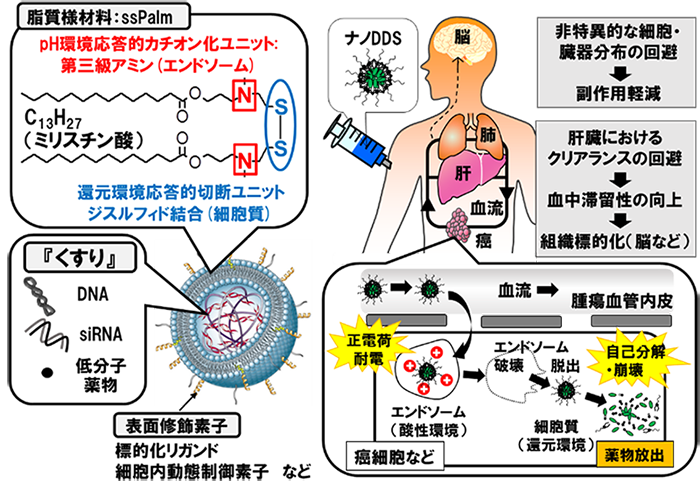
体内動態と細胞内動態を制御するマルチ創剤基盤材料(ssPalm)の開発と応用
永年の間、遺伝子や核酸デリバリーシステムには、カチオン性(正電荷)材料が用いられてきました。この背景には、カチオン性材料が遺伝子や核酸と静電的な複合体を形成し、ナノサイズの粒子を簡便に調製できることや、正に帯電したナノ粒子が、細胞表面のヘパリン硫酸などと静電的に相互作用しながら、高い効率で細胞内へ取りこまれるということが挙げられます。しかし、私達は、これらカチオン性材料は一旦細胞内に取り込まれると、静電的な相互作用を介して遺伝子やmRNAと相互作用し、転写や翻訳過程を阻害してしまうことを発見しました。即ち、細胞外における遺伝子の安定的なナノ粒子形成能が、細胞内においてはその転写を阻害する諸悪の根源となってしまいます。
そこで私達は、永年の間にわたり多用されてきたカチオン性材料を極力排除することで、電荷的に『中性』な遺伝子・核酸導入ベクターを開発しました。このナノ粒子を構成する鍵となる脂質様材料が、ss-cleavable and pH-activated lipid-like material (ssPalm)です。この分子には、細胞内の環境に応答して『生体膜を突破』し、『自己崩壊』する能力を付与しています。現在、本分子の構造を分子レベルでチューニングし、細胞内動態制御能や崩壊能を高めると共に、様々な核酸や低分子化合物のパッケージング法を開発しながら、その応用を拡張しています。また、本粒子の機能を高め、また、動態を制御するために、様々な表面修飾素子の開発も進めています。
ssPalmは、現在、日油株式会社より販売を開始しています。私達は、技術レベルや応用性を高めながら、学会発表や論文発表をすすめていきたいと考えています。これらの報告を御覧頂き、企業の研究者の皆様方に自社技術を融合させて有用性を見いだして頂く。このようなサイクルが回れば、アカデミアとして創薬研究へ貢献できるのではないかと期待しています。
研究テーマ2
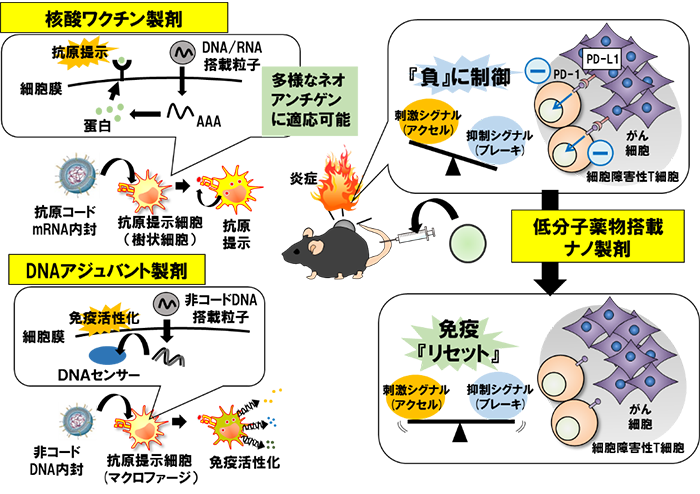
生体内イムノエンジニアリング法の開発と難治性疾患治療への応用
永年にわたり癌免疫療法の実用化が困難な時代が続いてきました。この要因として、腫瘍組織の免疫が抑制されていることが発見されました。この負の癌免疫制御機構を阻害する抗体医薬(免疫チェックポイント阻害剤)がヒト臨床試験において有効であることが示されたことにより、がん免疫療法は、外科療法、化学療法、放射線療法に続く第4のがん治療法としての地位を固めつつあります。折しも、ヒトゲノム情報が安価に解読されるようになり、これらのビッグデータを保管し、統合して解析する技術も急速に進歩しています。これにより癌免疫療法への適用に資するネオアンチゲン(変異遺伝子やスプライシングバリアント)の同定も急速に進むと考えられます。正に、癌免疫治療にも個別化医療が進みつつあると言っても過言ではありません。DNA/RNAワクチンは、これら核酸にコードされるタンパク情報を改変するだけで多様な抗原へ適用できるワクチン基盤であり、多彩な抗原を用いたがん免疫療法の実現に大きく貢献ができます。また、特にDNAは、細胞質内に存在するセンサーを刺激することで、癌治療に有効とされる細胞性免疫を活性化する新たな機構が最近明らかとなりました。そこで、私達は、上記のssPalm分子や、表面修飾素子を開発しながら、免疫担当細胞群に効率的に遺伝子・核酸を導入し、抗原情報を教育し、同時に活性化する技術開発を進めています。その一方で、既存の低分子薬物を用いて癌免疫環境を矯正できる、安価な製剤を開発したいと考えています。
核酸や低分子デリバリー技術を基盤とし、生体内の免疫を包括的に操り、癌や炎症などの難治性疾患を治療する生体内イムノエンジニアリングを実現したいと考えています。
研究テーマ3
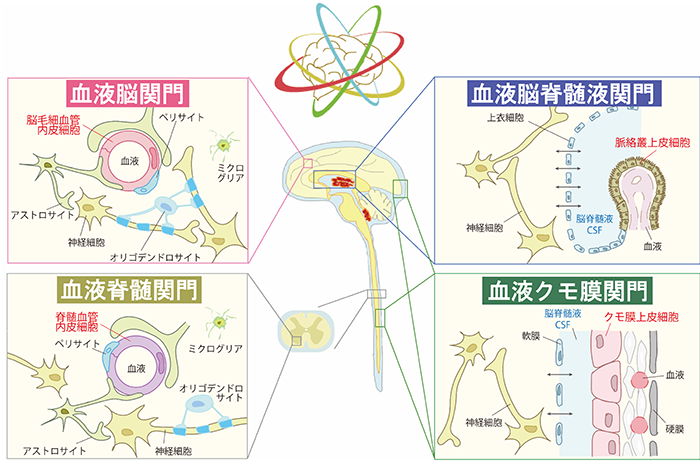
オミクス技術を用いて中枢関門の仕組みを解き明かし、中枢疾患創薬の突破口を拓く
中枢組織には、血液脳関門(BBB)に加えて、血液脳脊髄液関門(BCSFB)、血液クモ膜関門(BAB)および血液脊髄関門(BSCB)の4種類の関門組織が存在し、末梢(血液)と中枢組織内を隔てています。これらをまとめて中枢関門と呼びます。
中枢疾患治療薬の新薬開発における課題
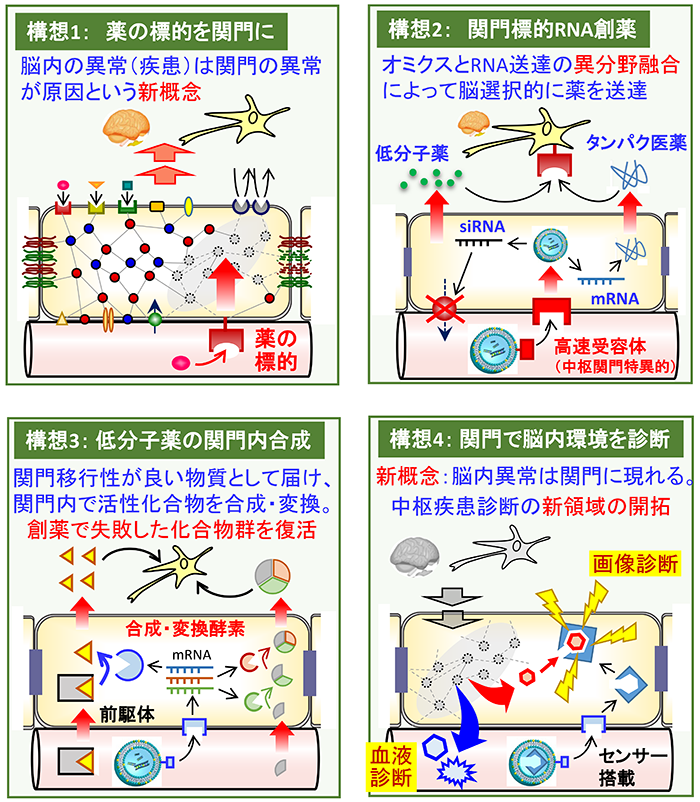
①薬の標的となる分子は中枢関門を超えた中枢組織内に存在するという概念が一般的であるため、②薬は中枢関門を通過して中枢組織内へ到達する必要がありますが、99%以上の薬はP糖タンパク(P-gp)などの排出ポンプによって中枢への侵入が妨げられています。③タンパク質・遺伝子やナノ粒子などの高分子に至っては中枢関門を全く通過できません。これらの重要課題を解決するため、以下の4つの構想を具現化していき、新学問「バリア制御学」を創成することを目標に、日々、研究に取り組んでいます。
構想1
中枢関門の通過を必要としない創薬。中枢関門の細胞自体を薬の標的と捉え、創薬を行うことで、脳移行性の課題を解決する。中枢関門は、良くも悪くも脳内環境に影響を与えているため、中枢内の病気の原因は、関門の異常によるものであり、その異常を治療することによって、中枢疾患が治療されるというこれまでにない新しい創薬戦略を確立する。
構想2
他臓器にはなく、中枢関門特異的に高発現する膜タンパク質を利用して、RNAを搭載している脂質ナノ粒子を中枢関門細胞内へ選択的に届ける技術を確立する。これによって、先ず、P-gpのsiRNAを送達することによって、中枢関門のみのP-gpをノックダウンし、副作用のない、脳移行性改善を行うことによって、新薬開発でドロップアウトしている8割もの候補化合物を救う。また、高速で内在化できる膜タンパク質を利用して、mRNAを搭載した脂質ナノ粒子を関門細胞へ導入し、目的タンパク質を合成させることによって脳内へ速やかにあらゆるタンパク質医薬を届ける仕組みを構築する。
構想3
低分子医薬品についても、関門細胞で合成される仕組みを作る。すなわち、これまでの創薬の歴史において、薬理作用はあるけれども、そのままの構造では関門を通過できず、ドロップアウトしてきた莫大な化合物の利用価値を見出す。具体的には、関門内へ届きやすい構造として関門細胞内へ届け、関門細胞内で化学反応を起こさせ、薬理作用のある活性化合物に変換する仕組みを構築することで、これまで中枢内へ到達しなかった、または末梢臓器に副作用があった化合物を中枢疾患治療薬として利用できるようにする。
構想4
血管年齢の診断が生活習慣病のチェックに利用されているように、中枢関門の“年齢”を診断することによって、今後の中枢疾患の発症予測を行う仕組みを作る。世界的に、中枢疾患の診断は、脳を採取して生検することはできないため、血液バイオマーカーを用いた診断やイメージングプローブを脳へ届けて検査する方式が主流である。しかし、脳内の異常物質が関門を透過しづらく血液中に現れにくいことや、イメージングプローブも脳移行性が良いものに限られている。これに対して、中枢関門細胞は血液へ面しており、血液中へその構成成分が流れ出やすいため、関門内の異常分子機構をとらえ、その一部の成分を対象に血液診断することによって、中枢関門の状態を診断できる。また、上述の仕組みで、診断プローブを中枢関門選択的に導入できるため、診断プローブ自体の脳移行性の良し悪しに関わらず、あらゆる診断プローブを導入でき、中枢関門の環境を測定することができる。中枢関門の状態、すなわち“年齢”、は中枢疾患の予兆を反映するものであるため、この中枢関門診断によって、中枢疾患の診断学を劇的に変革できる。










