ゲノム医療薬学分野でおこなっている研究テーマの背景
薬物療法において、同じ薬を投与しても、体内動態(吸収・分布・代謝・排泄)、薬効の強さ、さらには副作用の発現率まで、人によって大きく異なることが知られています。こうした「薬物応答性」の個人差には、肝・腎・心機能、年齢、性別、生活リズム(サーカディアンリズム)、食事、併用薬、健康食品など、さまざまな要因が関わっています。
近年、こうした要因の一つとして特に注目されているのが、ヒトゲノム上のわずかなDNA配列の違い、すなわち「遺伝子多型」です。もし、薬物投与前に遺伝学的検査によって患者さんの遺伝型を把握できれば、その人に最適な薬剤の種類、投与量、タイミングをあらかじめ予測できる可能性があります。これは、必要最小限の薬剤で最大の治療効果を引き出し、副作用を最小限に抑える「個別化薬物療法」の実現に直結します。
このような視点から、現在世界中で「薬剤反応性」と「遺伝子多型」の関連を明らかにする研究が進められており、この分野はゲノム薬理学(pharmacogenomics)、薬理遺伝学(pharmacogenetics)とも呼ばれ、今や次世代医療の中心的な学問領域となっています。
では、具体的にどの遺伝子の、どの配列部位(遺伝型)を調べれば、薬物動態・薬効・副作用などの「表現型」が予測できるのでしょうか?
これまでに、薬物代謝酵素、トランスポーター、薬物標的受容体など、多数の遺伝子多型が報告されており、その一部については薬剤との関連性が明らかになっています。しかし実際に、遺伝型から個人の薬剤反応性を高精度に予測できるマーカーはまだ限られています。
日本における保険適用ファーマコゲノミクスマーカーは、わずか3つの遺伝子にとどまっています。すなわち、抗がん剤イリノテカンに関連するUGT1A1、免疫抑制剤アザチオプリンや6-メルカプトプリンに関連するNUDT15、および多発性硬化症治療薬シポニモドの代謝に関与するCYP2C9です。この限られた適用範囲は、まだ研究成果が十分に臨床応用されていない現状を反映しているともいえるでしょう。
私たち、東北大学大学院薬学研究科「ゲノム医療薬学分野」では、この課題に真正面から取り組んでいます。2011年の東日本大震災を契機に設立された東北メディカル・メガバンク機構(ToMMo)では、15万人規模の住民を対象とした大規模ゲノムコホート研究が進行しており、特に10万人規模の全ゲノム配列データベースは、日本人におけるゲノム多様性の理解において世界的にも貴重な資源となっています。このデータを活用し、私たちは従来見落とされてきた「低頻度遺伝子多型(レアバリアント)」の中から、薬剤反応性に影響を及ぼす重要な変異を見出す研究を展開しています。具体的には、人工的に調製した組換え薬物代謝酵素タンパク質を用いた網羅的な機能変化解析により、活性に著しい影響を及ぼすバリアントを新たに同定する試みです。
これにより、より多くの医薬品に対して、患者の遺伝型に基づいた最適な薬剤選択・投与量設計が可能となり、「科学的根拠に基づく個別化薬物療法」の実現に向けて大きく前進できると私たちは信じています。
これまで多くの研究者や薬剤師が、患者一人ひとりに最適な医療を届けるという思いのもと、「薬剤反応性」と「ゲノム情報」の関連解明に挑戦してきました。そして今、その成果がようやく臨床の現場で活用され始めています。これからの時代は、より多くの医薬品に対して、ゲノム情報を活用した個別化医療が標準となっていくでしょう。
その未来を、私たちと一緒に切り拓いてみませんか?
研究内容
1. ファーマコゲノミクス(PGx)解析による個別化薬物療法への応用研究

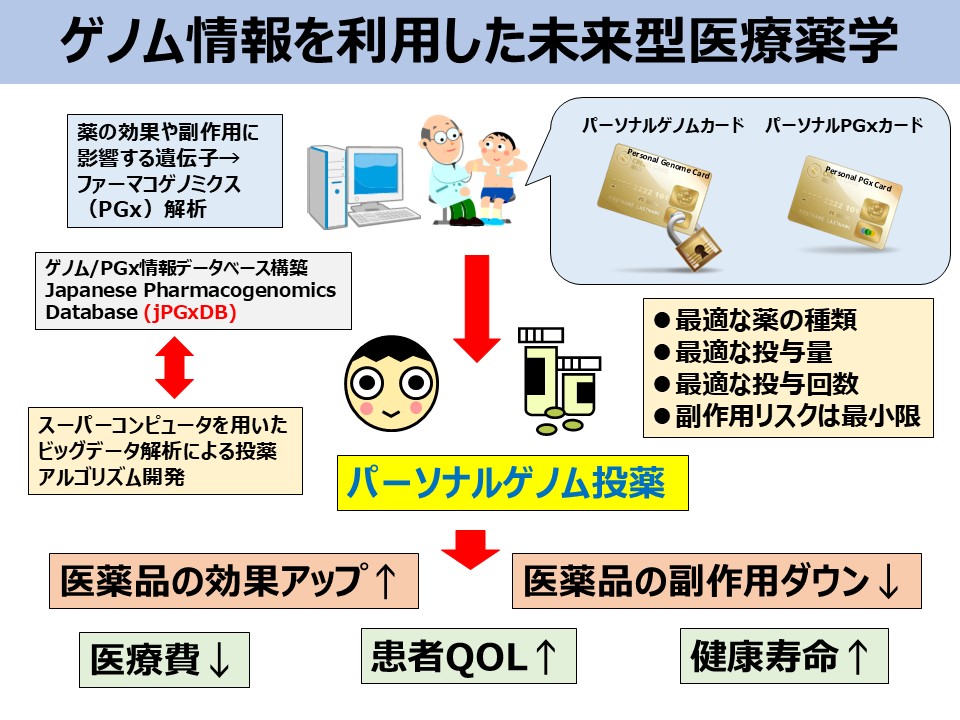
悪性腫瘍治療において、抗がん剤の効果や副作用の発現には著しい個人差が認められます。この薬物応答性の個人差の一因として、抗がん剤の体内動態を制御する薬物代謝酵素をコードする遺伝子の塩基多型が多数報告されています。特に、イリノテカンや6-メルカプトプリンなど一部の抗がん剤では、患者ごとの副作用発現と代謝酵素遺伝子多型との間に強い関連が認められており、UGT1A1やNUDT15遺伝子多型検査はすでに保険適用されています。一方で、婦人科がん治療のキードラッグであるタキサン系のパクリタキセル(PTX)やプラチナ系のカルボプラチン(CBDCA)、さらには大腸がんなどに用いられるフッ化ピリミジン系抗がん剤である5-フルオロウラシル(5-FU)については、どの分子の遺伝子多型が薬物動態・薬効・副作用発現の予測に有用であるか、いまだコンセンサスが得られておらず、有用なPGxマーカーの同定には至っておりません。
PTX、CBDCA、5-FUでは、重篤な副作用として末梢神経障害や骨髄抑制が発現することがあり、これらは治療の延期や中断を招くだけでなく、患者さんのQOL(Quality of Life)を著しく損ないます。したがって、治療開始前に遺伝的な薬物応答性を予測することは極めて重要です。例えば、PTXは体内で薬物代謝酵素CYP3A4/3A5およびCYP2C8によって解毒代謝されますが、これらの酵素活性が遺伝的に低下している患者さんでは、副作用のリスクが高くなると報告されています。一方で、単一の遺伝子多型だけでは副作用との明確な関連が認められない例も多く、抗がん剤の体内動態と遺伝的背景の複雑さが示唆されています。
そこで、我々の研究室では、悪性腫瘍に対する抗がん剤の個別化療法を実現するために、東北大学の病院個別化医療センター、未来型医療創成センター、そして東北メディカル・メガバンク機構のバイオバンクを活用し、薬物応答性関連遺伝子多型(ファーマコゲノミクス:PGxマーカー)に関するレトロスペクティブ探索研究を実施いたします。
具体的には、卵巣がん、子宮がん(子宮体がん・子宮頸がん)、乳がん、大腸がん等の患者さんから得られたDNAを用いて、日本人集団に特化したSNPアレイ(ジャポニカアレイ)や次世代シークエンサー(NGS)を用いた薬物動態関連遺伝子のターゲットシークエンス解析を行います。さらに、Genome-Wide Association Study(GWAS)およびPolygenic Risk Score(PRS)の手法を駆使し、特定の抗がん剤(タキサン系、プラチナ系、フッ化ピリミジン系)に対する薬物応答性に関連する新規PGxマーカーの同定を目指します。
特に、薬物代謝酵素やトランスポーターなど、薬物動態に関連する遺伝子多型は、従来から薬物応答性の個人差に関与する重要な分子として報告されているため、同様の遺伝子多型が同定された場合には、バリアントタンパク質の機能解析までを行い、その作用機序の解明を行います。さらに、PGxマーカーの遺伝子検査キットの開発を目指し、ジャポニカアレイへのアドオンや、我々が独自に開発してきた核酸クロマトグラフィーストリップ法の応用開発を進めてまいります。このようなPGx研究により個別化薬物療法への応用を実現することが目標です。
2. 薬物代謝酵素遺伝子多型に基づくバリアント酵素ライブラリーの構築と薬物動態予測
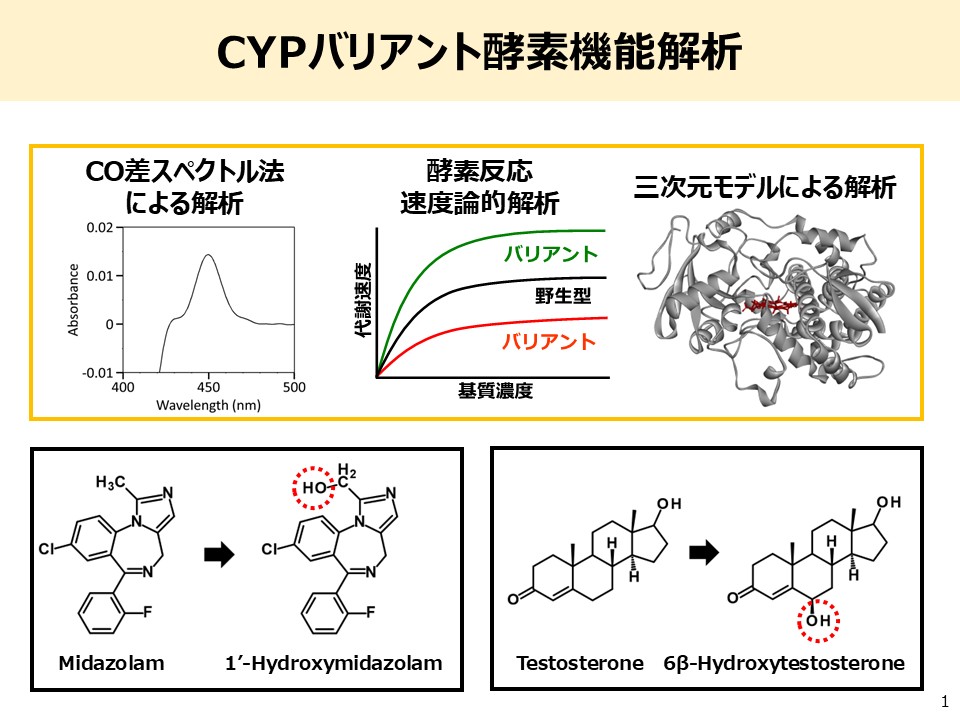
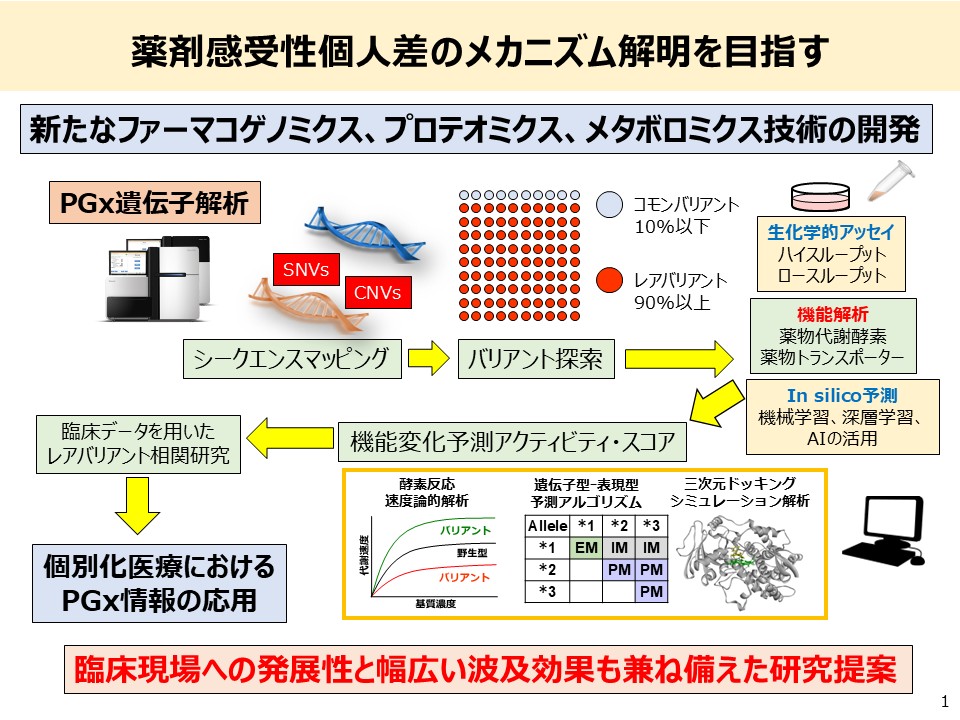
医薬品の有効性および副作用には顕著な個人差が存在しており、その主要な要因として、薬物代謝酵素遺伝子の多型が挙げられます。個々の患者に対して安全かつ効果的な薬物療法を実現するためには、個人の薬剤感受性を高精度に予測可能なバイオマーカーの開発が喫緊の課題です。
特に、医薬品の体内動態に関与する酵素活性は、遺伝子配列上の一塩基多型(SNP)などの変異により大きく変動することが明らかになっています。しかし、遺伝子配列が変化してもタンパク質機能に影響を及ぼさない場合がある一方で、単一の変異によって著しい機能変化を引き起こすこともあります。そのため、ゲノム情報の解読に加えて、実際の酵素活性に基づく機能評価が不可欠です。
現時点では、薬物代謝酵素の遺伝的バリアントが引き起こす機能変化の実態は十分に解明されておらず、臨床で活用されているファーマコゲノミクス(PGx)検査は極めて限定的です。このような背景のもと、ゲノム医療の応用を推進するためには、得られたゲノム情報に基づく薬物代謝酵素バリアントの機能的評価が不可欠です。
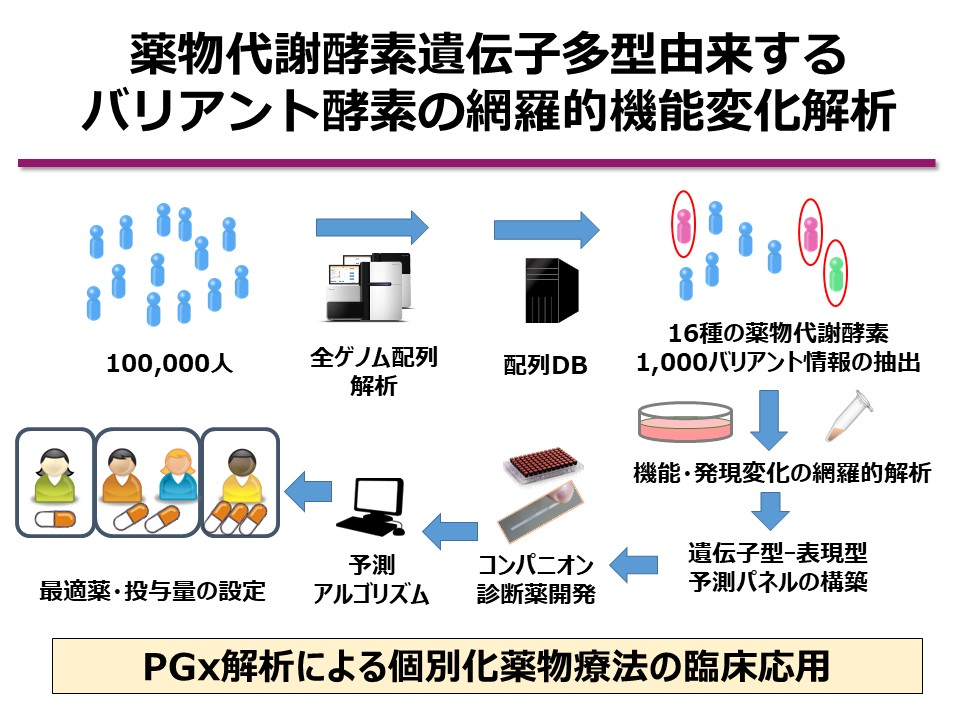
私たちの研究室では、東北メディカル・メガバンク機構が整備した一般住民を対象とするバイオバンクの全ゲノム配列情報を活用し、CYP(シトクロムP450)を含む主要な16種類の薬物代謝酵素について、約1,000種類の組換え酵素バリアントを作製し、網羅的な機能解析を実施します。これにより、従来不明であった低頻度遺伝子多型による機能変化を明らかにし、遺伝子型から表現型への予測精度を飛躍的に高める薬物動態予測パネルの構築を目指します。
私たちの研究室では、これまでに独自の手法を用いて約1,000種類のアミノ酸置換型薬物代謝酵素バリアントを作製し、それらの活性変化を網羅的に解析してまいりました。一方で、従来の研究は高頻度多型に偏っており、低頻度多型の同定および機能解析が十分に行われていないという課題があります。
私たちが独自に開発した「哺乳動物細胞株による組換えCYP発現系」および「薬物代謝酵素バリアントライブラリー」を最大限に活用し、遺伝的背景に起因する薬物動態の個人差の実態解明に取り組みます。具体的には、日本人集団で同定された遺伝子多型に基づき、ミスセンスおよびナンセンス変異を導入した組換え酵素を作製し、酵素反応速度論的解析を通じて機能変化を定量的に評価します。
得られたキネティックパラメータに基づき、各バリアントに対してアクティビティ・スコアを定義し、「遺伝子型–表現型予測パネル」を構築します。さらに、日本人集団におけるバリアント頻度情報を活用し、集団レベルでの予測表現型頻度も推定します。
今回新たに解析を行う1,000種と、これまでに得られた1,000種の解析結果を統合することで、合計2,000種に及ぶバリアントの機能変化を網羅的に明らかにします。本パネルは世界的にも最大規模となり、特に日本人特有の遺伝的背景を反映した予測ツールとして極めて高い有用性を有します。
さらに、薬物代謝酵素のnon-coding領域に存在する多型が遺伝子発現量に与える影響についても、ミニジーン発現系を用いて検証を行います。得られた解析結果は、東北大学および東北メディカル・メガバンク機構が公開する日本人マルチオミックス参照データベース「jMorp」に格納し、Web上で無償公開する予定です。
このように、大規模な一般住民バイオバンクの全ゲノム配列データに基づいて、薬物代謝酵素の機能や発現変化を網羅的に解析した先行事例は、国際的にも存在しません。本研究を通じて、革新的な「遺伝的薬物代謝酵素活性予測パネル」を構築することで、薬剤感受性の高精度予測を実現し、個別化医療の臨床応用を大きく前進させることが期待されます。将来的には、マルチオミクス、miRNA、エピゲノム、臨床情報等の統合により、PGx検査の医療実装を一層加速するための基盤を構築してまいります。
3. ミトコンドリアDNA多型による薬剤誘発性難聴の個別化予防に関する研究
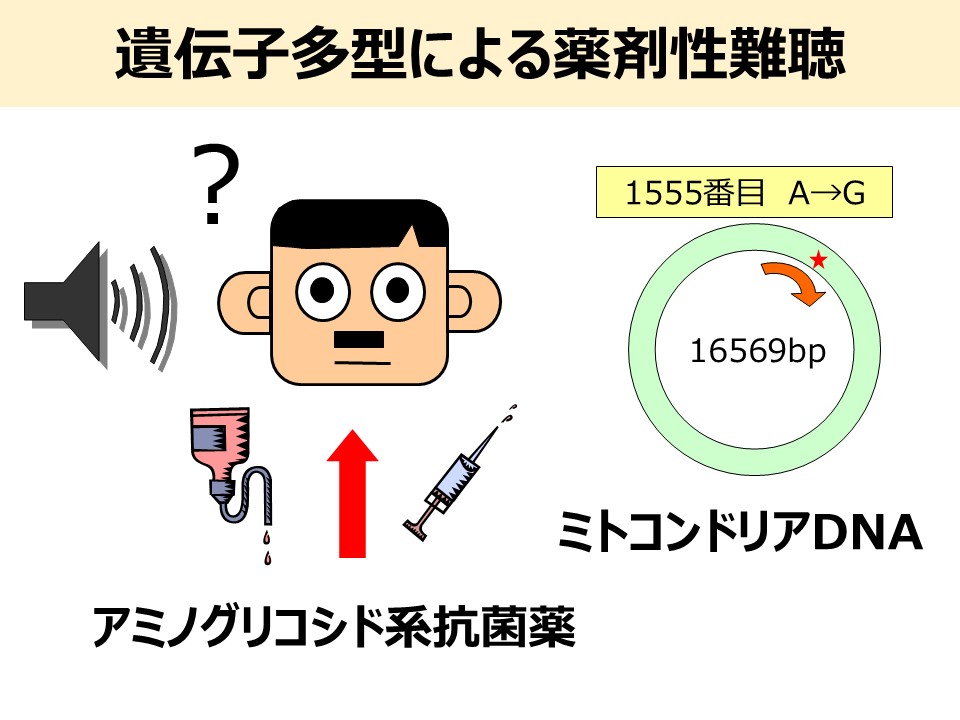
ミトコンドリアDNA 1555A>G多型を有する患者さんにおいて、アミノグリコシド系抗菌薬(特にストレプトマイシン)による感音性難聴の高頻度な発症は、1993年に米国で初めて報告されました。その後、1997年には日本でも同様の症例が報告され、詳細な家系解析が行われています。現在、ミトコンドリアDNA 1555A>G多型の他にも1494C>Tや1095T>C多型を有する場合もアミノグリコシド系抗菌薬誘発難聴が報告されています。しかし、このミトコンドリアDNA多型の遺伝学的検査は、一部の医療機関でのみ実施されているにすぎません。また、検出方法も多くの施設ではPCRとゲル電気泳動によって行われており、操作が煩雑であるため、外来患者さんへの迅速な遺伝子診断には対応が困難です。今後、個別化医療が急速に発展し、個人の遺伝子情報が効果的かつ安全な薬物療法の実施に不可欠となることが予想されることから、簡便かつ迅速な遺伝学的検査法の整備が求められています。
これまでに私たちの研究室では、リアルタイムPCRを用いて、約1時間でミトコンドリアDNA 1555A>G多型を同定可能な方法を開発してまいりました。しかしながら、この方法は高価な検出機器を必要とするため、コスト面を考慮すると中小病院や診療所への導入は現実的ではありませんでした。そこで、比較的低コストで遺伝子診断を可能とし、かつ診療現場やベッドサイドにおいて医療従事者が簡便に使用できる方法(核酸クロマトグラフィーストリップを用いたマルチプレックス検査法)の開発を目指します。このように、臨床現場で即応用可能な遺伝子診断系の構築は、社会的貢献度が非常に高いと考えています。なお、ミトコンドリアDNAは母系遺伝により子孫へ伝搬するため、一人の患者さんの遺伝学的検査することで、その近親者(兄弟姉妹、子ども、母親など)のミトコンドリアDNA遺伝子型を推定することができ、薬剤性の感覚器障害を効率的に回避する先進的な医療への展開が可能になります。
また、これまでに、アミノグリコシド系抗菌薬の投与歴がないにもかかわらず、1555A>G多型を保有する方が若年期に難聴を発症した症例も報告されています(Matsunaga et al., Laryngoscope, 2004)。このことから、アミノグリコシド系抗菌薬以外の薬剤や環境中の化学物質が同様の機序で内耳の細胞に障害を与えていることが示唆されます。しかし、これまでにそのような原因化合物の毒性を評価するスクリーニング系は報告されていません。そこで、私たちの研究室では、薬剤性難聴を誘発する化合物のスクリーニングシステムを構築しようと考えています。方法としては、ミトコンドリアDNA 1555A>G、1494C>T、1095T>C多型を有するヒトのリンパ球を不死化し、そこからミトコンドリアのリボソームRNAを抽出します。それらと薬剤性難聴誘発化合物との結合率を測定し、原因化合物を特定していきます。クライオ電子顕微鏡を用いて、結合の可視化に成功すれば、毒性発現メカニズムの解明や創薬への展開も期待されます。このような取り組みは、薬剤性難聴の個別化予防を推進するうえで、極めて大きな社会的メリットをもたらします。さらに、この研究成果を基に聴覚障害の発症および保因者のQOL低下を回避できれば、治療関連の医療費を削減し、難聴患者の増加に伴う社会経済的損失の軽減にもつながることが期待されます。




