AZADO
- AZADO酸化
- 開発した酸化反応
- AZADO、1-Me-AZADOの入手法と合成法
- AZADO酸化の応用例
- AZADO酸化の豆知識
- AZADO使用マニュアル
- 次亜塩素酸ナトリウム滴定法
- ワンポット酸化マニュアル
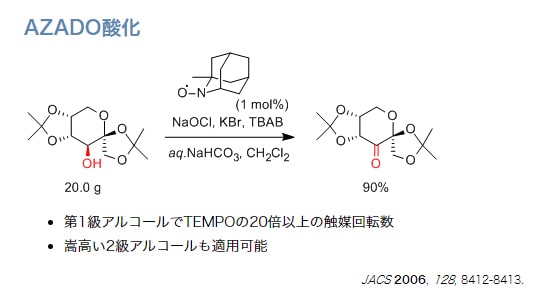
AZADO酸化
精密有機合成の分野においてアルコールの酸化反応は、もっとも基本的な反応の一つです。そのため、低分子医薬品、化粧品や香料等の化学合成においては、必須の製造プロセスです。しかしながら、これまでに開発された反応の多くは、下記に挙げるように問題を抱えています。
- ・クロム酸酸化(Jones酸化、PCC、PDF酸化等)…毒性廃棄物
- ・Swern酸化…極低温、悪臭
- ・Dess-Martin、IBX酸化…大量の廃棄物、爆発性
- 1.立体的に混み合っている2級アルコールには適用できない。
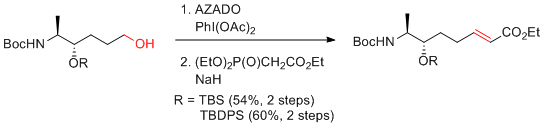
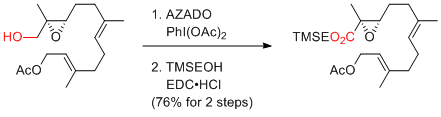
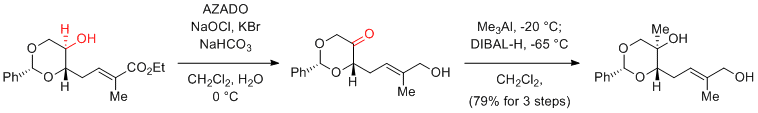
- 2.オレフィンを有する基質の酸化の場合、次亜塩素酸ナトリウムは用いることができず、PhI(OAc)2等を共酸化剤として用いる必要がある。
- 3.第1級アルコールからカルボン酸へのワンポット酸化反応の基質適用性が乏しい。

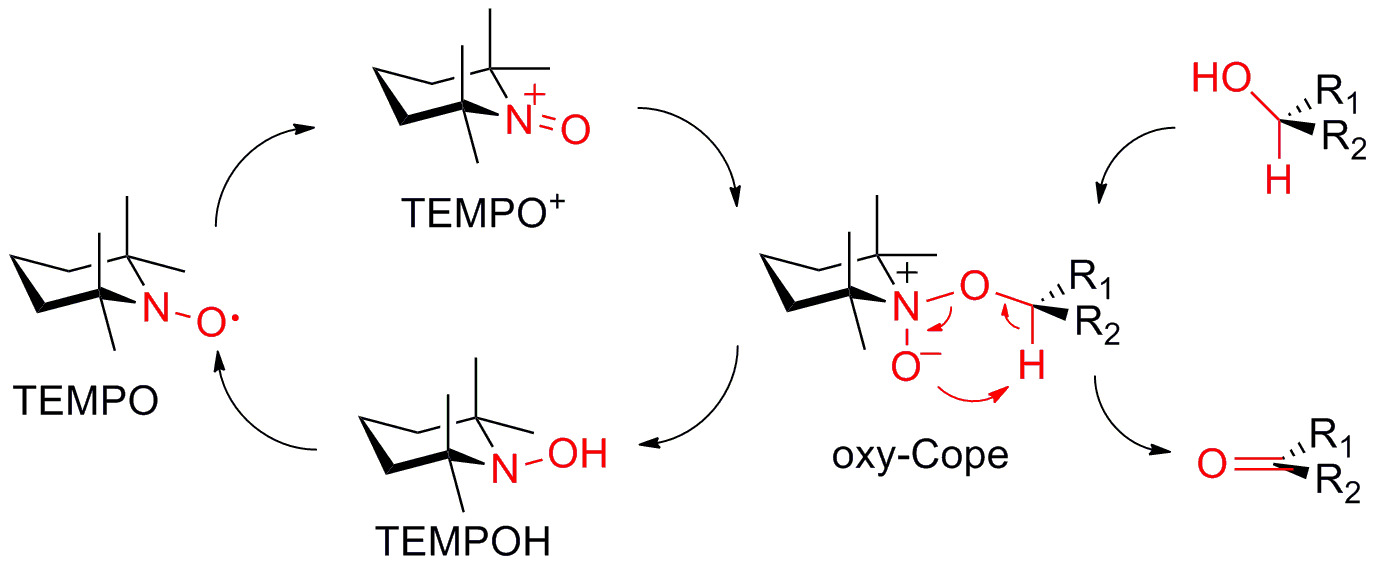
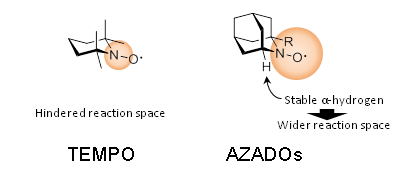
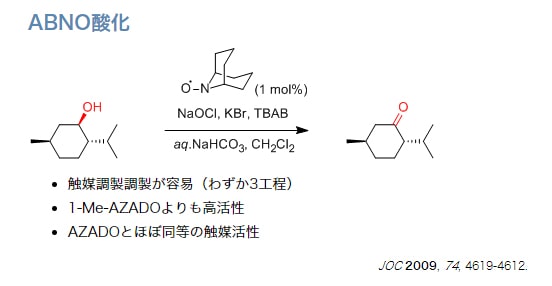
私達の研究室では、新しい触媒や反応系のデザインによって、これらのTEMPO酸化の問題点の解決に取り組んできました。2-azaadamantane N-oxyl (AZADO)は、アダマンタン骨格の特性を利用してニトロキシルラジカルα位に水素原子を安定に配置させ、触媒活性部周辺の嵩高さを軽減することで、嵩高いアルコールも接近できるように設計した触媒です。AZADOは、第1級アルコールの酸化では、TEMPOの約20倍の触媒回転数を示しかつ、TEMPO酸化で適用できない嵩高い第2級アルコールにおいても速やかに酸化が進行します。

開発した酸化反応
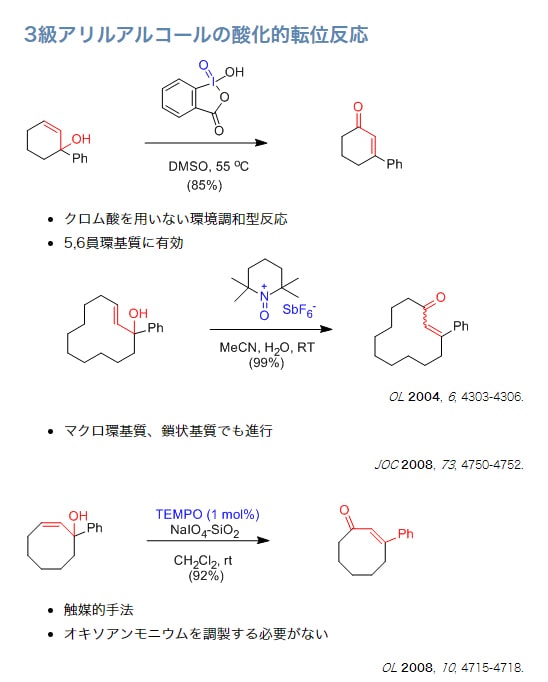
AZADO、1-Me-AZADOの入手法と合成法
AZADOと1-Me-AZADOは、和光純薬とSIGMA-ALDRICH社より販売されています。
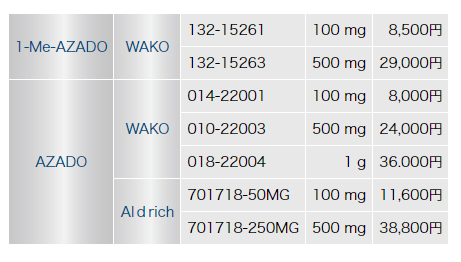
Wako Organic Square No.29 1
http://www.wako-chem.co.jp/siyaku/journal/org/pdf/org29.pdf
和光純薬時報 January 2007, vol 75, No. 1
http://www.wako-chem.co.jp/siyaku/journal/jiho/pdf/jiho751.pdf
AZADOの企業化に向けた研究は、科学技術振興機構JSTの「平成19年度 産学共同シーズイノベーション化事業 顕在化ステージ」に採択され、日産化学工業との共同研究によってわずか4工程の短工程合成法が開発されました。この方法によって、安価で大量入手可能な2-アダマンタノンよりAZADOをキログラムスケールで合成ができるようになりました。
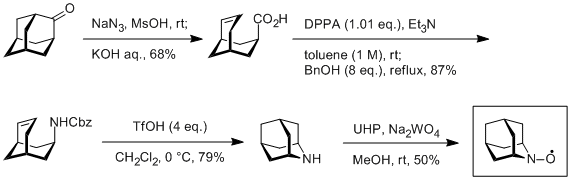

AZADO
当研究室では、配属された学部3年生の練習プログラムとして毎年1人5gを作っています。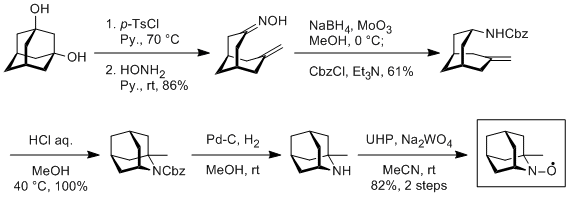

1-Me-AZADO

Wako Organic Square No.29 1
http://www.wako-chem.co.jp/siyaku/journal/org/pdf/org29.pdf
和光純薬時報 January 2007, vol 75, No. 1
http://www.wako-chem.co.jp/siyaku/journal/jiho/pdf/jiho751.pdf
AZADOの企業化に向けた研究は、科学技術振興機構JSTの「平成19年度 産学共同シーズイノベーション化事業 顕在化ステージ」に採択され、日産化学工業との共同研究によってわずか4工程の短工程合成法が開発されました。この方法によって、安価で大量入手可能な2-アダマンタノンよりAZADOをキログラムスケールで合成ができるようになりました。


AZADO
Nissan/Tohoku route
1-Me-AZADOは、1,3-アダマンタンジオールから6工程で合成できます。当研究室では、配属された学部3年生の練習プログラムとして毎年1人5gを作っています。


1-Me-AZADO
AZADO酸化の応用例
- 2021
- 2020
- 2019
- 2018
- 2017
- 2016
- 2015
- 2014
- 2013
- 2012
- 2011
- 2010
- 2009
- 2008
- 2007
2021
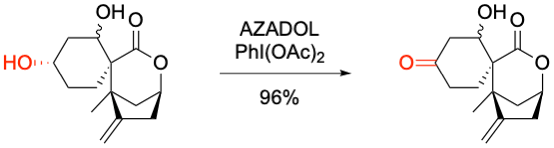
H. Imagawa et al. Tetrahedron Lett. 2021, 64, 152723.
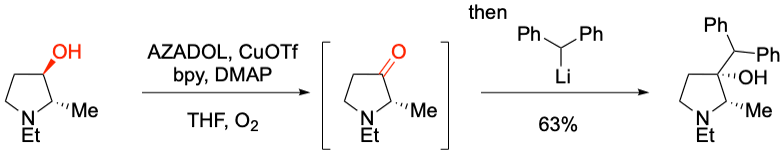
Y. Iwabuchi et al. Chem. Eur. J. 2021, 27, 1961-1965.

C. Tsukano, Y. Takemoto et al. Org. Lett. 2021, 23, 676-681.
2020

X.-Y. Liu, Y. Qin et al. Angew. Chem. Int. Ed. 2020, 59, 23609-23614.

H. Tokuyama et al. Tetrahedron 2020, 76, 131630.
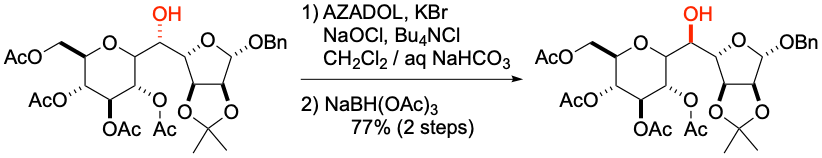
M. Inoue et al. Org. Lett. 2020, 22, 6468-6472.
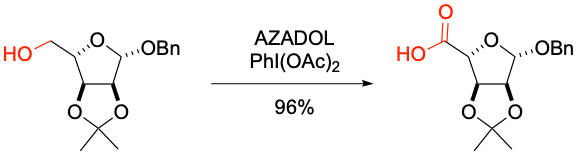
M. Inoue et al. Org. Lett. 2020, 22, 6468-6472.
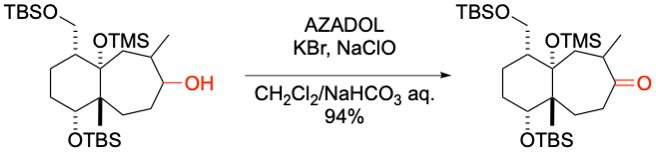
T. Kobayashi, H. Ito et al. Org. Biomol. Chem. 2020, 18, 7316-7320.
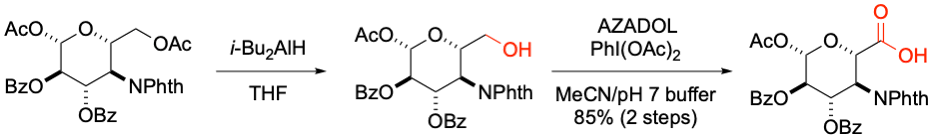
M. Inoue et al. J. Am. Chem. Soc. 2020, 142, 13227-13234.
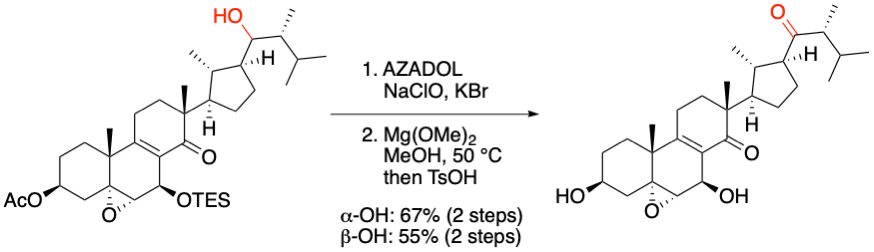
S. Sato, S. Kuwahara Org. Lett. 2020, 22, 1311-1315.
S. Kuwahara et al. Tetrahedron 2020, 131129.
S. Kuwahara et al. Tetrahedron 2020, 131129.
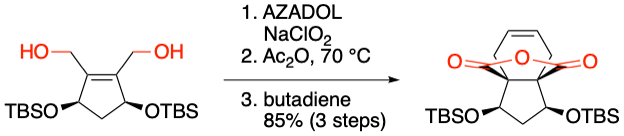
S. Yokoshima et al. Synlett 2020, 31, 290-294.
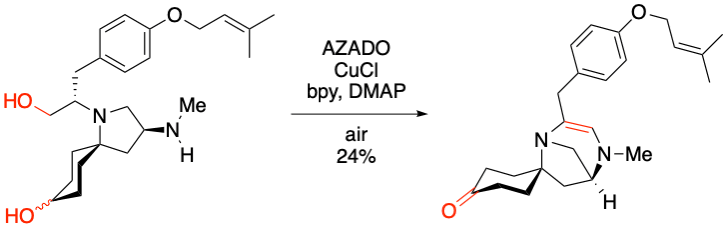
M. J. Gaunt et al. Angew. Chem. Int. Ed. 2020, 59, 2256-2261.
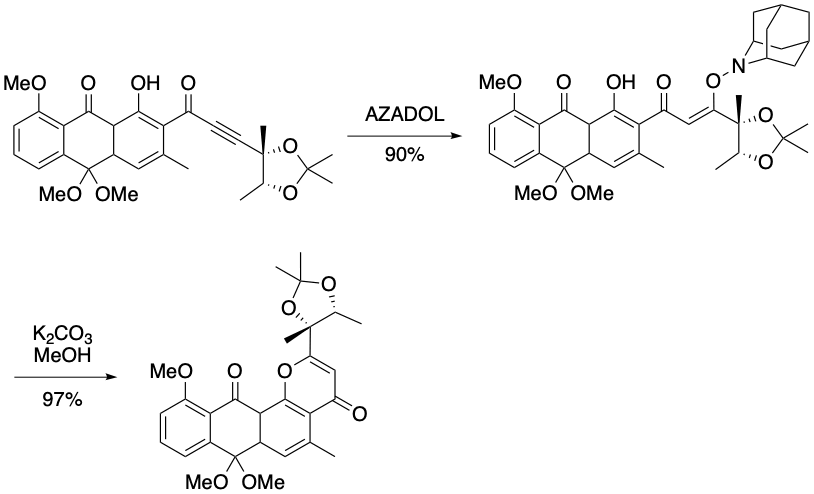
K. Suzuki et al. Org. Lett. 2020, 22, 175-179.
K. Suzuki et al. Org. Lett. 2020, 22, 175-179.
2019
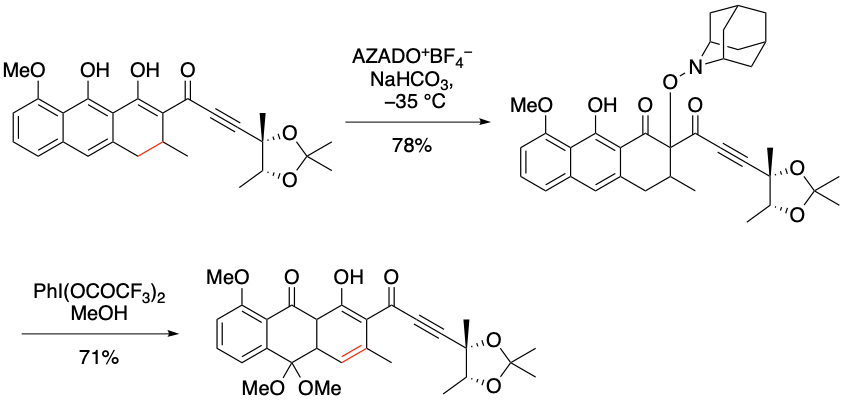
I. Hayakawa, A. Sakakura et al. J. Org. Chem. 2019, 84, 15614-15623.
I. Hayakawa, A. Sakakura et al. J. Org. Chem. 2019, 84, 15614-15623.
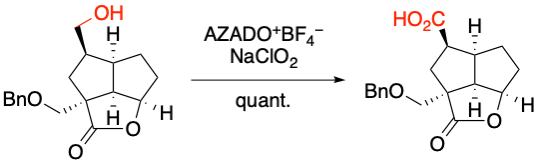
I. Hayakawa, A. Sakakura et al. J. Org. Chem. 2019, 84, 15614-15623.
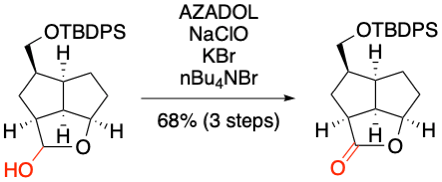
I. Hayakawa, A. Sakakura et al. J. Org. Chem. 2019, 84, 15614-15623.
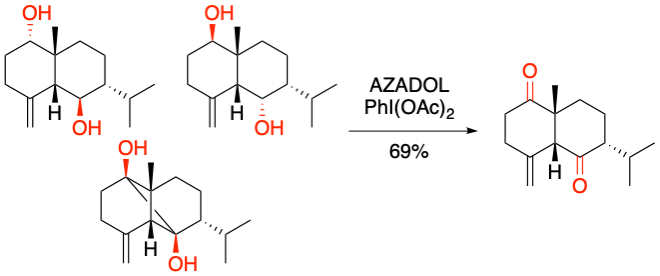
M. Inoue et al. Org. Lett. 2019, 21, 7619-7623.
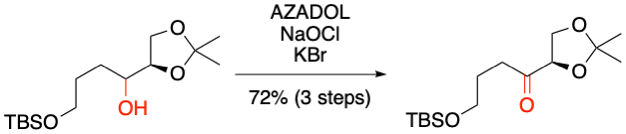
M. Shibuya, Y. Yamamoto et al. J. Org. Chem. 2019, 84, 12508-12519.
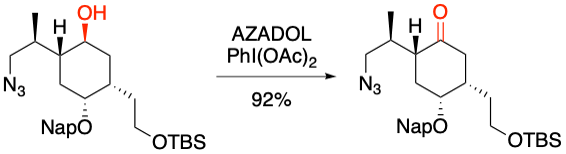
I. Hayakawa, A. Sakakura et al. Org. Lett. 2019, 21, 6337-6341.
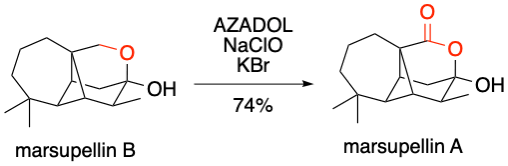
K. Takatori et al. Org. Lett. 2019, 21, 6054-6057.
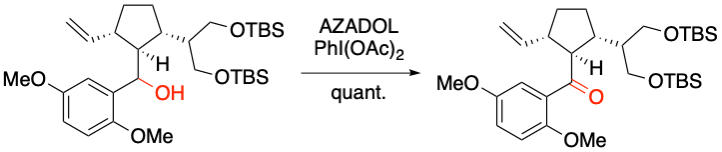
H. Ito et al. Org. Lett. 2019, 21, 6199-6201.
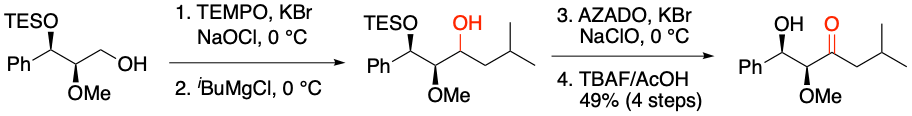
Y. Igarashi et al. J. Antibiot. 2019, 72, 653-660.

K. Mori Tetrahedron 2019, 75, 3387-3398.

K. Mori Tetrahedron 2019, 75, 3387-3398.
Y. Guo, T. Ye et al. Org. Lett. 2019, 21, 3670-3673.
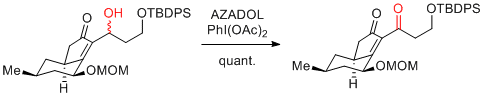
H. Takayama et al. J. Org. Chem. 2019, 84, 5645-5654.
K. Takashima, N. Toyooka et al. J. Org. Chem. 2019, 84, 5222-5229.

Y. Iwabuchi et al. Org. Biomol. Chem. 2019, 17, 3581-3589.
Y. Iwabuchi et al. Org. Biomol. Chem. 2019, 17, 3581-3589.
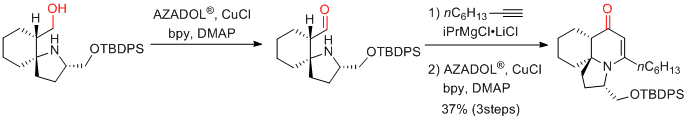
T. Sato, N. Chida et al. Angew. Chem. Int. Ed. 2019, 58, 4381-4385.
2018
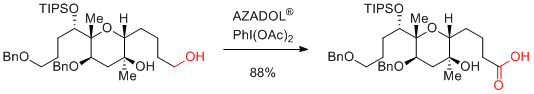
M. Sasaki et al. Org. Lett. 2018, 20, 7163-7166.
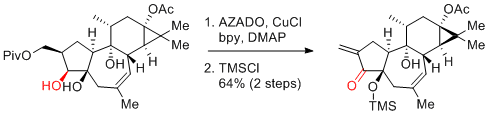
P. Li et al. Chem 2018, 4, 2944-2954.

S. Kim et al. Org. Lett. 2018, 20, 6121-6125.
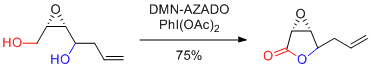
M. Ubukata et al. Bioorg. Med. Chem. 2018, 26, 5159-5168.
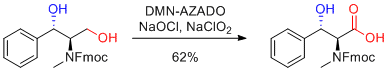
H. Konno et al. Tetrahedron 2018, 74, 6173-6181.
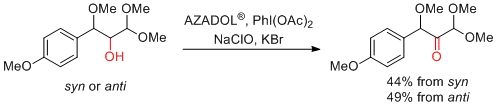
H. Miyabe et al. J. Org. Chem. 2018, 83, 8962-8970.
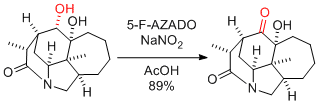
Y. Iwabuchi et al. Org. Lett. 2018, 20, 3053-3056.
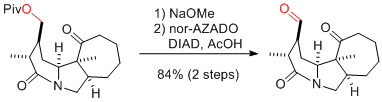
Y. Iwabuchi et al. Org. Lett. 2018, 20, 3053-3056.
T. Shinada et al. Tetrahedron 2018, 74, 2664-2668.
S. Kobayashi, K. Nagai et al. Tetrahedron Lett. 2018, 59, 1733-1736.
Y. Morimoto et al. RSC Adv. 2018, 8, 11296-11303.

K. Suenaga et al. Tetrahedron Lett. 2018, 59, 1360-1362.

T. Sugai et al. Tetrahedron 2018, 74, 740-745.

A. Matsuda et al. Bioorg. Med. Chem. 2018, 26, 3763-3772.
A. Matsuda et al. Bioorg. Med. Chem. 2018, 26, 3763-3772.
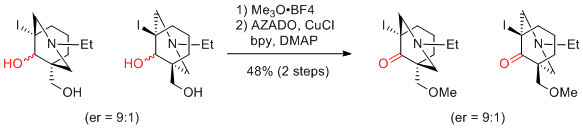
M. Inoue et al. J. Antibiot. 2018, 71, 326-332.
2017
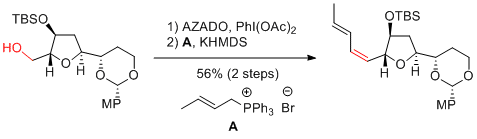
H. Takamura et al. Chem. Eur. J. 2017, 23, 17191-17194.

M. Shoji, T. Sugai et al. Tetrahedron 2017, 73, 7217-7222.

M. Inoue et al. J. Am. Chem. Soc. 2017, 139, 16420-16429.
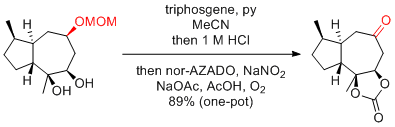
Y. Iwabuchi et al. Org. Lett. 2017, 19, 5142-5145.

C. Tsukano, Y. Takemoto et al. Nat. Commun. 2017, 8, article No. 674
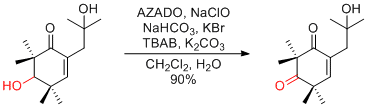
H. Tan et al. Org. Lett. 2017, 19, 4786-4789.
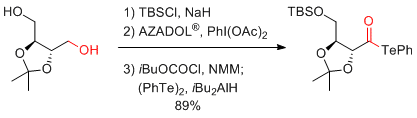
M. Inoue et al. Angew. Chem. Int. Ed. 2017, 56, 11865-11869.
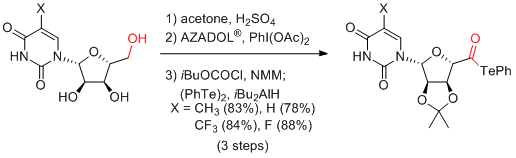
M. Inoue et al. Angew. Chem. Int. Ed. 2017, 56, 11865-11869.
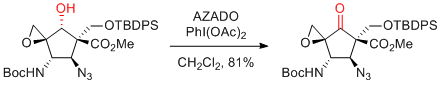
T. Kan et al. Org. Lett. 2017, 19, 3358-3361.

M. L. Clarke et al. Org. Lett. 2017, 19, 2845-2848.
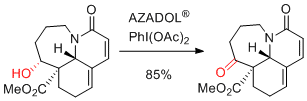
H. Takayama et al. Org. Lett. 2017, 19, 2722-2725.
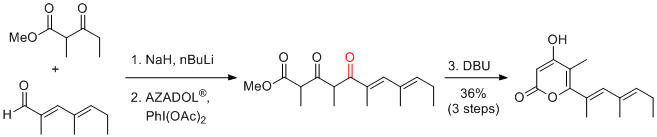
A. Sakakura et al. Synlett 2017, 28, 1596-1600.
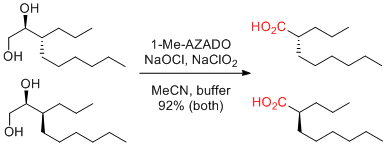
V. A. Bhosale, S. B. Waghmode Tetrahedron 2017, 73, 2342-2348.
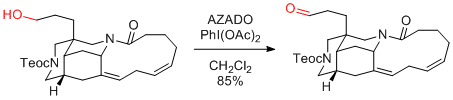
T. Sato, N. Chida et al. J. Am. Chem. Soc. 2017, 139, 2952-2955.
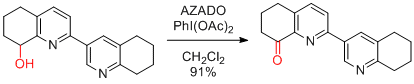
C. Tsukano et al. Chem. Eur. J. 2017, 29, 802-812.
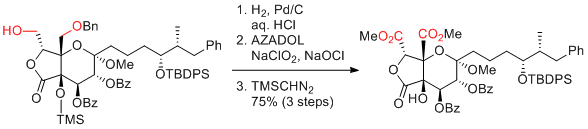
M. Inoue et al. J. Am. Chem. Soc. 2017, 139, 1814-1817.
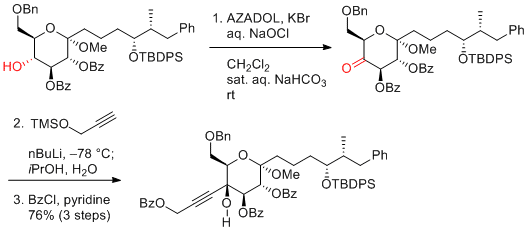
M. Inoue et al. J. Am. Chem. Soc. 2017, 139, 1814-1817.
2016
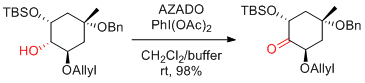
K. Toshima et al. Chem. Eur. J. 2016, 22, 18733-18736.
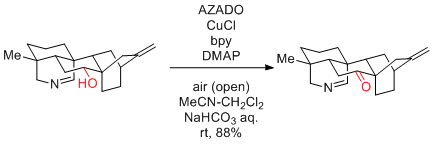
X.-Y. Liu, Y. Qin et al. Angew. Chem. Int. Ed. 2016, 55, 15667-15671.
T. Usuki et al. Tetrahedron Lett. 2016, 57, 5899-5901.
G. Zhang, Z. Gu et al. Org. Lett. 2016, 18, 5388-5391.
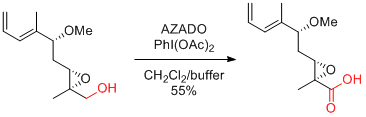
J. Huang and Z. Wang Org. Lett. 2016, 18, 4702-4705.
K. Mori Tetrahedron 2016, 72, 6578-6588.
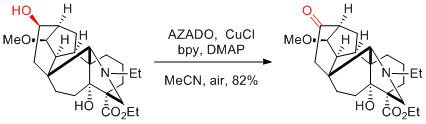
M. Inoue et al. Chem. Sci. 2016, 7, 4372-4378.
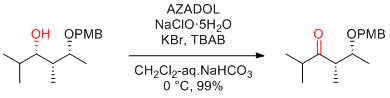
M. Murata et al. Tetrahedron Lett. 2016, 57, 2426-2429.
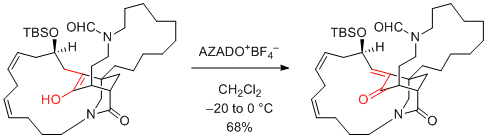
P.-Q. Huang et al. Angew. Chem. Int. Ed. 2016, 55, 4064-4068.
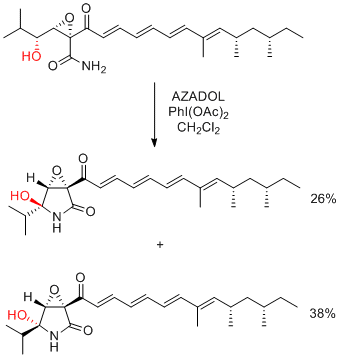
K. Kobayashi, H. Kogen et al. Org. Lett. 2016, 18, 1920-1923.
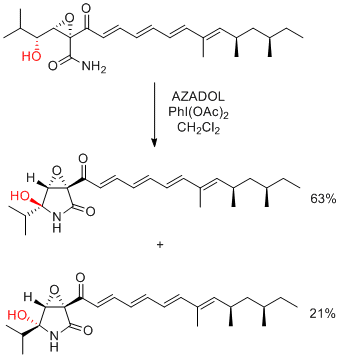
K. Kobayashi, H. Kogen et al. Org. Lett. 2016, 18, 1920-1923.
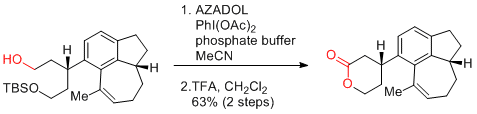
S. Yokoshima, T. Fukuyama et al. Angew. Chem. Int. Ed. 2016, 55, 6067-6070.
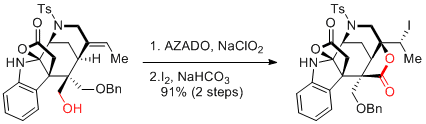
A. Li et al. J. Am. Chem. Soc. 2016, 138, 3982-3985.
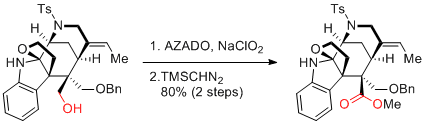
A. Li et al. J. Am. Chem. Soc. 2016, 138, 3982-3985.
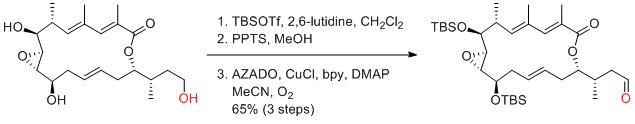
Y. Iwabuchi, N. Kanoh et al. J. Antibiotics 2016, 69, 287-293.
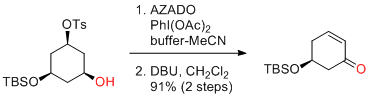
S. Yokoshima, T. Fukuyama et al. Org. Lett. 2016, 18, 1494-1496.
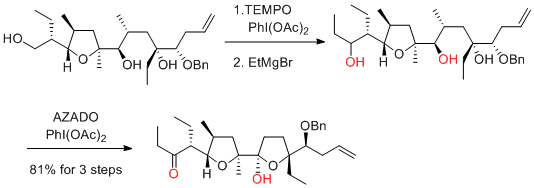
H.-S. Lee, S. H. Kang et al. Angew. Chem. Int. Ed. 2016, 55, 2573-2576.
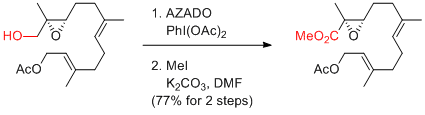
A. Li et al. Org. Chem. Front. 2016, 3, 368-374.
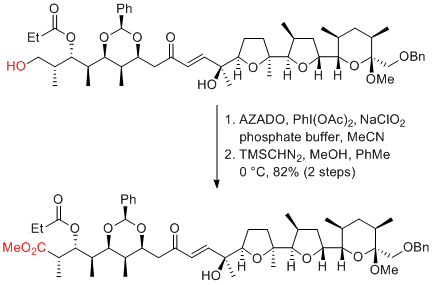
H.-S. Lee, S. H. Kang et al. Chem. Commun. 2016, 52, 3536-3539.
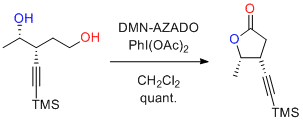
Y. Iwabuchi et al. Tetrahedron Lett. 2016, 57, 517-519.
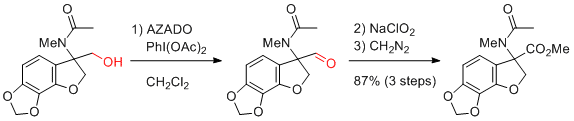
Y. Iwabuchi et al. Eur. J. Org. Chem. 2016, 270-273.
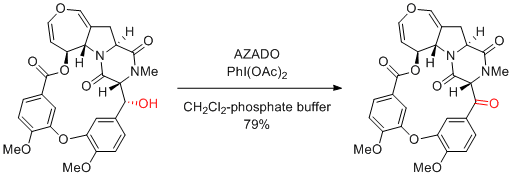
H. Tokuyama et al. Angew. Chem. Int. Ed. 2016, 55, 283-287.
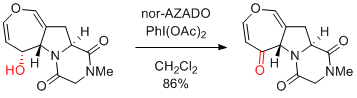
H. Tokuyama et al. Angew. Chem. Int. Ed. 2016, 55, 283-287.
2015
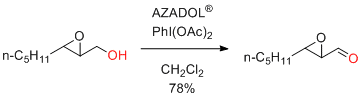
K. Mori et al. Tetrahedron Asymmetry 2015, 26, 861-867.
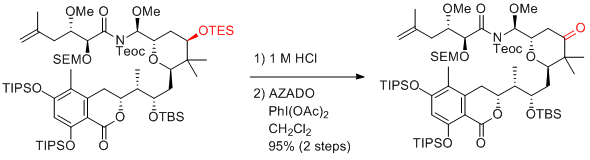
Y. Iwabuchi et al. J. Org. Chem. 2015, 80, 12333-12350.
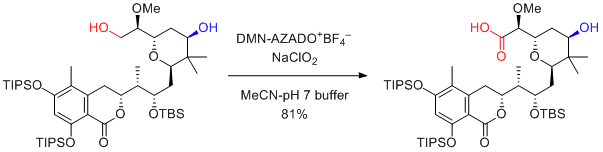
Y. Iwabuchi et al. J. Org. Chem. 2015, 80, 12333-12350.
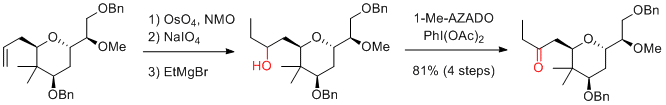
Y. Iwabuchi et al. J. Org. Chem. 2015, 80, 12333-12350.
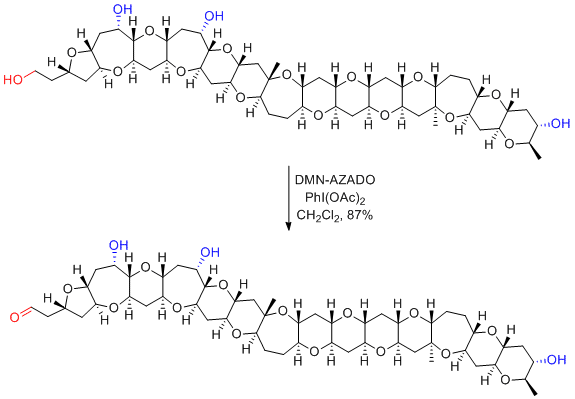
Y. Mori et al. J. Am. Chem. Soc. 2015, 137, 14513-14516.

M. Shindo et al. Chem. Eur. J. 2015, 21, 11590-11602.
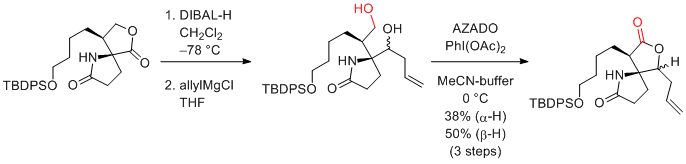
S. Yokoshima, T. Fukuyama et al. Synlett 2015, 26, 2131-2134.
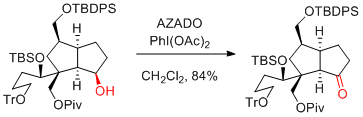
I. Hayakawa, H. Kigoshi et al. Chem. Commun. 2015, 51, 11568-11571.
Y. Hattori et al. Heterocycles 2015, 91, 959-969.
A. Li et al. Nat. Commun. 2015, 6, 6096.
H. Ohrui, S. Kuwahara et al. Org. Lett. 2015, 17, 828-831.
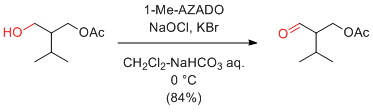
J. Tabata, R. T. Ichiki J. Chem. Ecol. 2015, 41, 194-201.
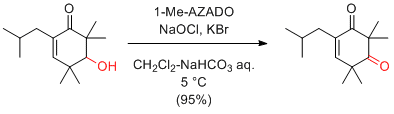
T. Shinada et al. Chem. Lett. 2015, 44, 445-447.
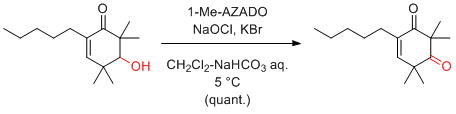
T. Shinada et al. Tetrahedron Lett. 2015, 56, 539-541.
2014
K. Nagasawa et al. Asian J. Org. Chem. 2014, 3, 1308-1311.
K. Nagasawa et al. Asian J. Org. Chem. 2014, 3, 1308-1311.
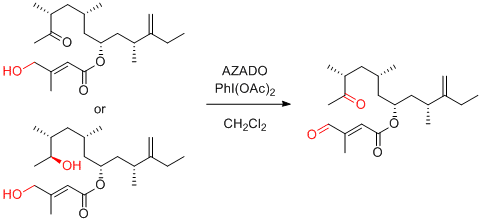
J. Kobayashi et al. Org. Lett. 2014, 16, 5624-5627.
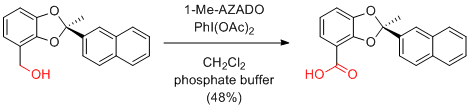
K. Hanaya et al. J. Mol. Catal. B: Enzym. 2014, 109, 130-135.
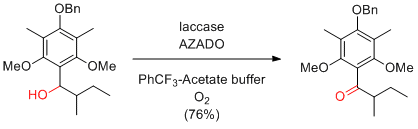
H. Ying et al. Green Chem. 2014, 16, 1131-1138.
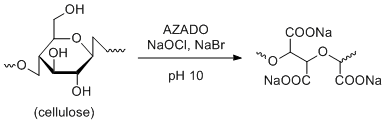
A. Isogai et al. Carbohydrate Polymers 2014, 110, 499-504.
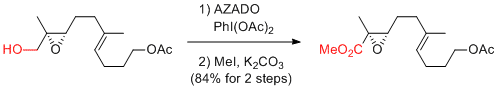
A. Li et al. Angew. Chem. Int. Ed. 2014, 53, 9012-9016.
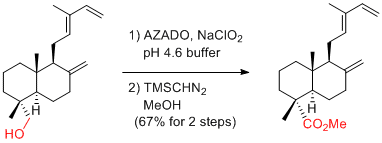
A. Li et al. J. Am. Chem. Soc. 2014, 136, 8185-8188.
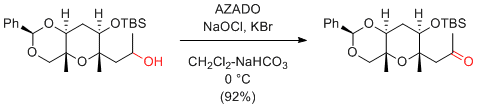
T. Oishi et al. J. Org. Chem. 2014, 79, 4948-4962.
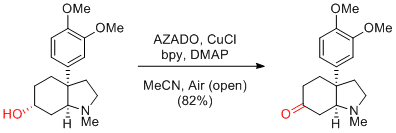
Y. Iwabuchi et al. Angew. Chem. Int. Ed. 2014, 53, 3236-3240.

Y. Iwabuchi et al. Angew. Chem. Int. Ed. 2014, 53, 3236-3240.
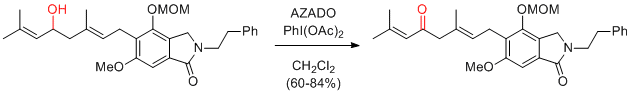
S. Kobayashi et al. J. Org. Chem. 2014, 79, 5227-5238.
S. Kobayashi et al. J. Org. Chem. 2014, 79, 5227-5238.
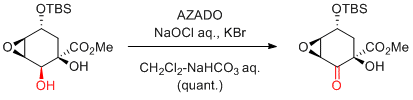
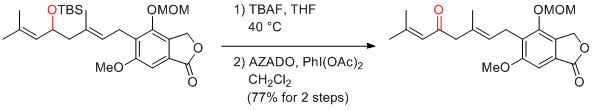
M. Shoji et al. Tetrahedron Lett. 2014, 55, 2856-2858.
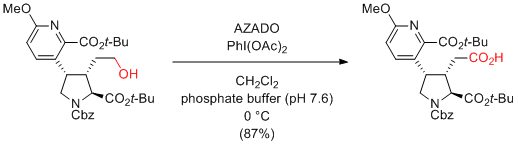
Y. Hamashima, T. Kan et al. Org. Lett. 2014, 16, 1980-1983.
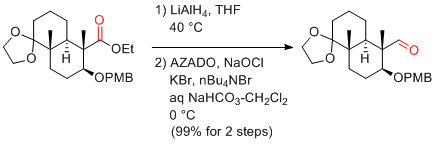
T. Teranishi, S. Kuwahara Tetrahedron Lett. 2014, 55, 1486-1487.
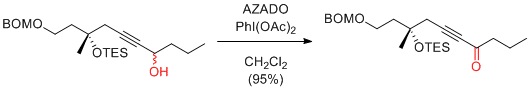
J. Kobayashi et al. RSC Adv. 2014, 4, 11073-11079.
2013
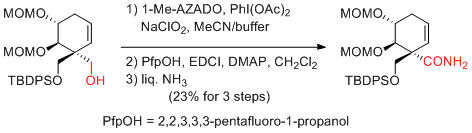
T. Kan et al. Eur. J. Org. Chem. 2013, 6789-6792.
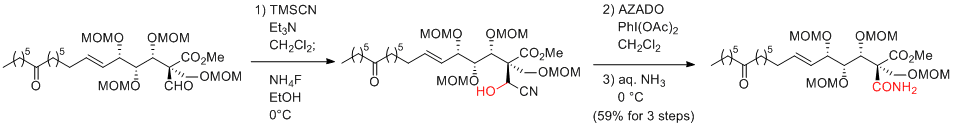
T. Kan et al. Eur. J. Org. Chem. 2013, 6789-6792.
K. Torikai et al. Synthesis 2013, 45, 2417-2425.
M. Inoue et al. J. Am. Chem. Soc. 2013, 135, 5467-5474.
S. H. Kang et al. Chem. Comm. 2013, 49, 5231-5233.
S. H. Kang et al. Chem. Comm. 2013, 49, 5231-5233.
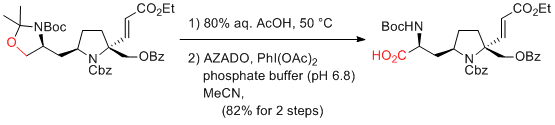
S. H. Kang et al. Chem. Comm. 2013, 49, 5231-5233.
2012
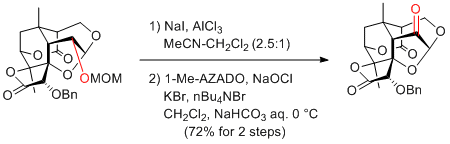
M. Sodeoka et al. Org. Lett. 2012, 14, 3434-3437.
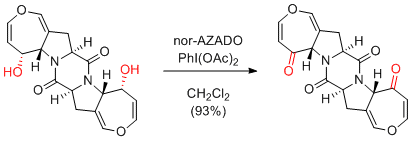
H. Tokuyama et al. Angew. Chem. Int. Ed. 2012, 51, 13062-13065.
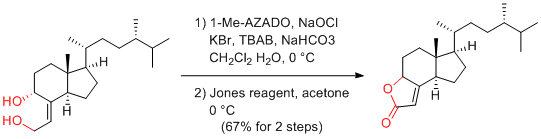
A. Yajima et al. Tetrahedron 2012, 68, 1729-1735.
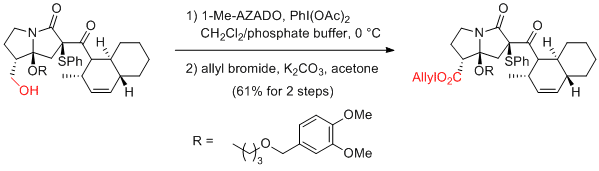
T. Kan et al. Angew. Chem. Int. Ed. 2012, 51, 12850-12853.
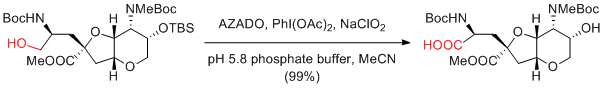
S. H. Kang et al. Chem. Commun. 2012, 48, 6295-6297.
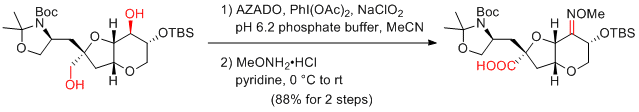
S. H. Kang et al. Chem. Commun. 2012, 48, 6295-6297.
2011
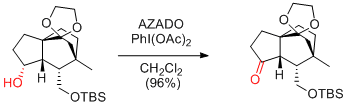
N. Kanoh, Y. Iwabuchi et al. Org. Lett. 2011, 13, 2864-2867.
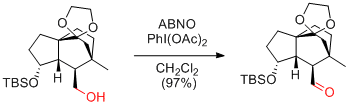
N. Kanoh, Y. Iwabuchi et al. Org. Lett. 2011, 13, 2864-2867.
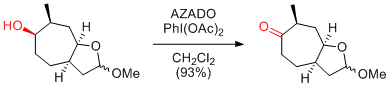
Y. Iwabuchi et al. Org. Lett. 2011, 13, 3620-3623.
2010
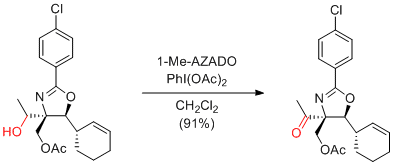
Y. Iwabuchi et al. Hetrocycles 2010, 81, 2239-2246.
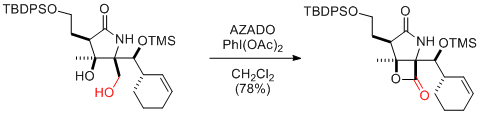
Y. Iwabuchi et al. Hetrocycles 2010, 81, 2239-2246.
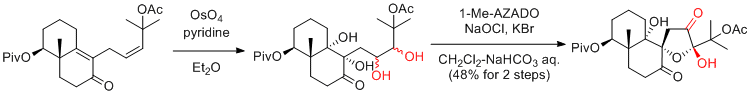
M. Enomoto, S. Kuwahara J. Org. Chem. 2010, 75, 6286-6289.
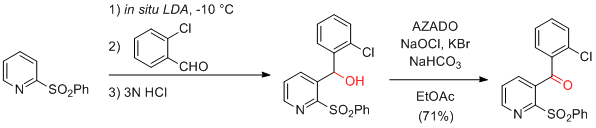
M. E. Kopach et al. Org. Proc. Res. Dev. 2010, 14, 1229-1238.
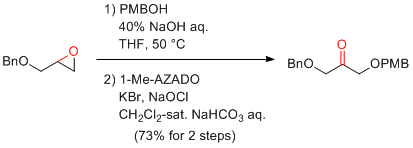
M. Shoji et al. Tetrahedron: Asymmetry 2010, 2043-2049.
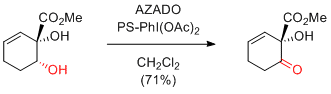
Y. Iwabuchi et al. Org. Lett. 2010, 12, 980-983.
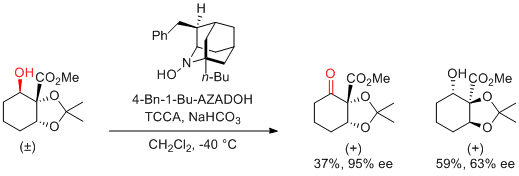
Y. Iwabuchi et al. Org. Lett. 2010, 12, 980-983.
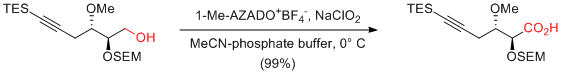
Y. Iwabuchi et al. Org. Lett. 2010, 12, 1040-1043
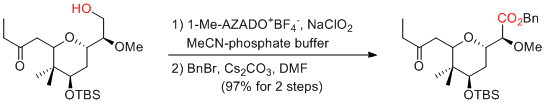
Y. Iwabuchi et al. Org. Lett. 2010, 12, 1040-1043.
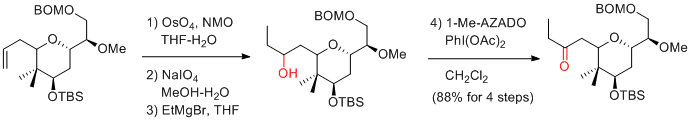
Y. Iwabuchi et al. Org. Lett. 2010, 12, 1040-1043.
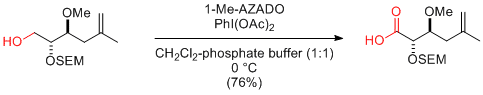
Y. Iwabuchi et al. Org. Lett. 2010, 12, 1040-1043.
2009
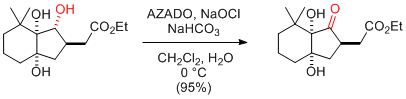
M. Shoji, M. Ueda et al. J. Org. Chem. 2009, 74, 3966-3969.
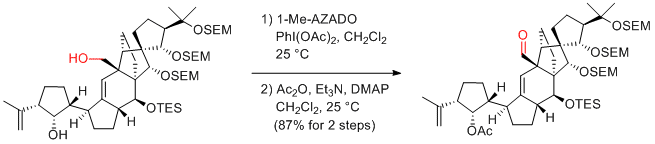
K. C. Nicolaou et al. Angew. Chem. Int. Ed. 2009, 48, 5648-5652.
K. C. Nicolaou et al. Angew. Chem. Int. Ed. 2009, 48, 5648-5652.
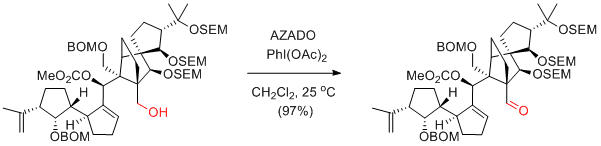
K. C. Nicolaou et al. Angew. Chem. Int. Ed. 2009, 48, 5648-5652.
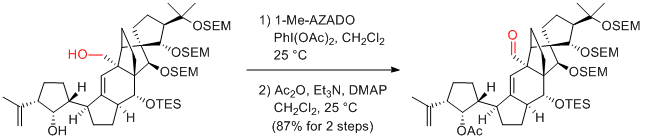
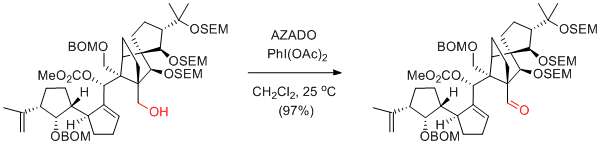
K. C. Nicolaou et al. Angew. Chem. Int. Ed. 2009, 48, 5642-5647.
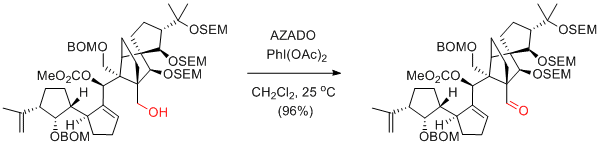
K. C. Nicolaou et al. Angew. Chem. Int. Ed. 2009, 48, 5642-5647.
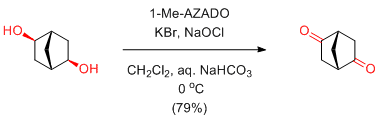
H. Sakurai et al. Chem. Asian J. 2009, 4, 1329-1337.
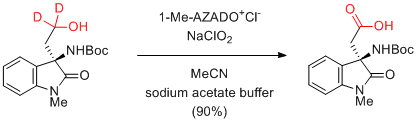
Y. Iwabuchi et al. J. Org. Chem. 2009, 74, 7522-7524.
Y. Iwabuchi et al. Chem. Commun. 2009, 6264-6266.
Y. Iwabuchi et al. Chem. Commun. 2009, 6264-6266.
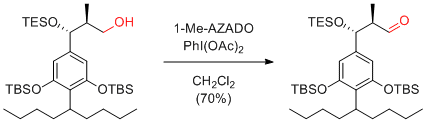
Y. Iwabuchi et al. Org. Biomol. Chem. 2009, 7, 3772-3781.
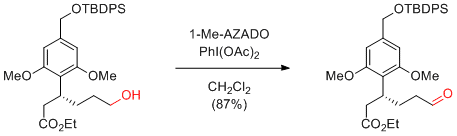
Y. Iwabuchi et al. Org. Biomol. Chem. 2009, 7, 3772-3781.
2008
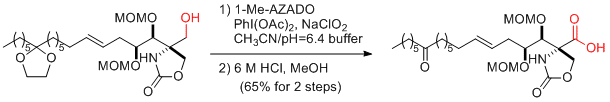
T. Kan et al. Tetrahedron: Asymmetry 2008, 19, 2771-2773.
2007
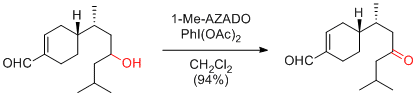
N. Itagaki, Y. Iwabuchi Chem. Commun. 2007, 1175-1176.
AZADO酸化の豆知識
共酸化剤の特徴と選び方
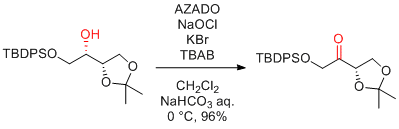
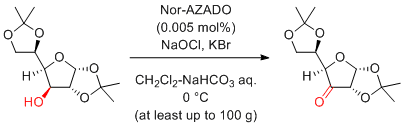
次亜塩素酸ナトリウム
…大量反応には最適
(安価で試薬由来の副生成物が少ない。反応速度も速い。)
ただし、二重結合を持つ基質は避けたほうがよい。
極性の高い第1級アルコールは、カルボン酸を生成しやすい。
Anelli's 条件 (AZADO or 1-Me-AZADO, NaOCl, KBr, Bu4NBr)
KBrやBu4NBrは、必須ではないが添加したほうが触媒効率が上がる。
臭化物イオンから、次亜臭素酸イオンが発生すると言われている。
二層系であるため、撹拌効率が重要。
次亜塩素酸ナトリウムは、活性が変わりやすいので、試薬びんを開封後長期間たったものは避けたほうがよい。
次亜塩素酸ナトリウムの活性は、ヨウ素でんぷん反応で滴定できる。
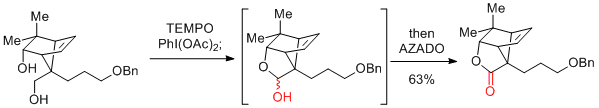
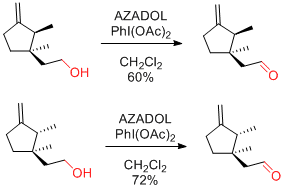
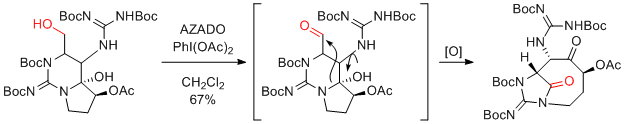
PhI(OAc)2(BAIB)
…高価だが、2重結合をもつ基質も適用可能。濃度依存的に反応速度が加速するので、できるかぎり高濃度にするとよい。(ただし、1mol/L以上は避けたほうがよい。)
次亜塩素酸ナトリウム等に比べ、反応時間が長い。
酢酸中での再結晶、水の添加が再現性を上げる場合がある。
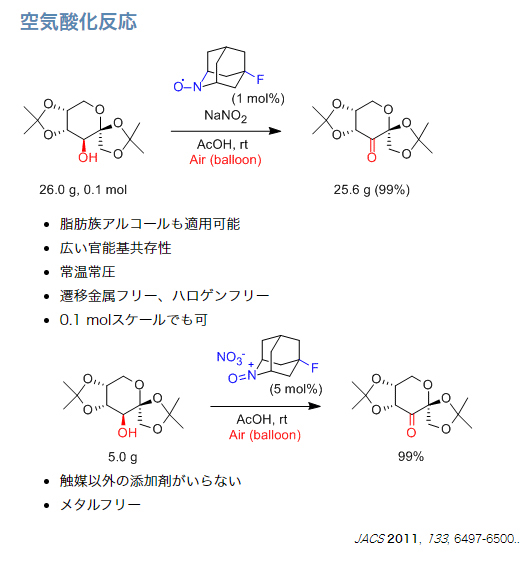
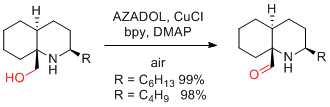
空気酸化
…1置環、2置換オレフィンを持つアルコール基質は適用できる。酢酸が必須。ただし、溶媒量ではなくてもよい(MeCN溶媒と酢酸3-10等量でも可)。
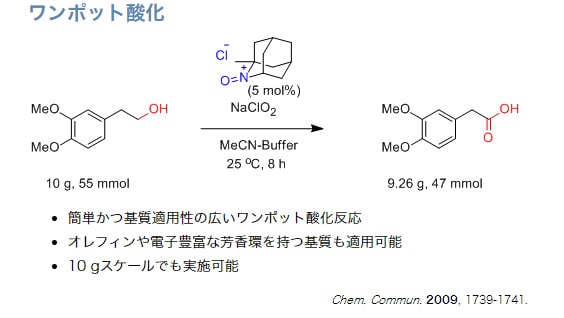
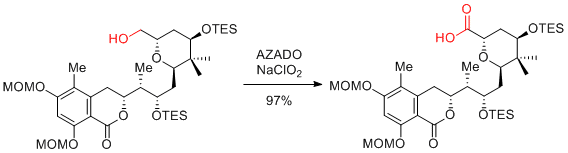
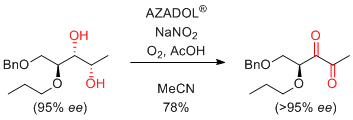
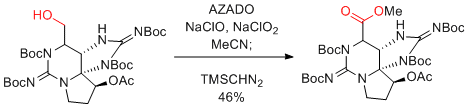
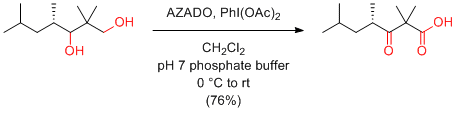
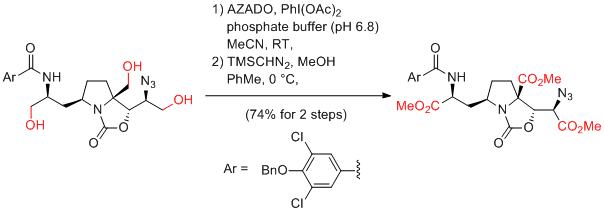
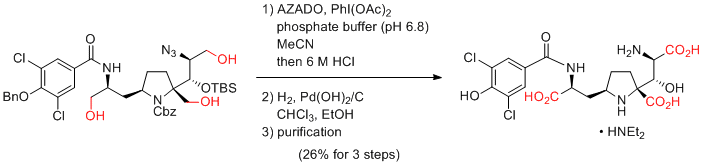
第1級アルコールからカルボン酸へのワンポット酸化反応
AZADO+X-/NaClO2条件が簡単で最も基質適用性が広いのでお勧め。TEMPOを用いたZhaoらの条件にAZADOを適用したAZADO/NaOCl(cat)/NaClO2も、TEMPOを用いた場合に比べ基質適用性は広い。
反応開始時と終了時に反応液が赤くなる場合が多い。
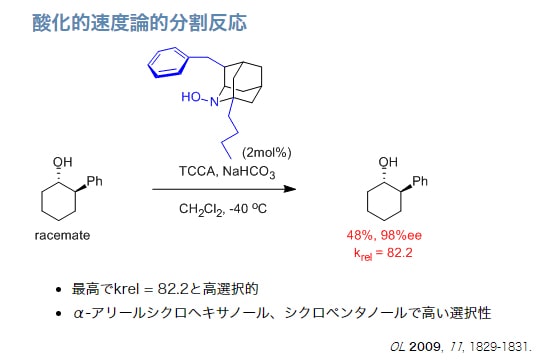
α-アミノアルコールも、ラセミ化しない。
