What's new
-
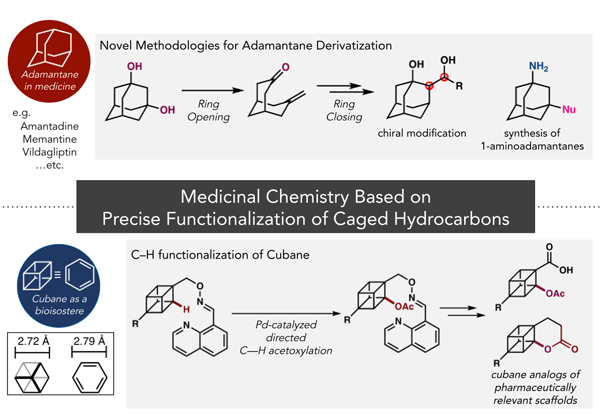
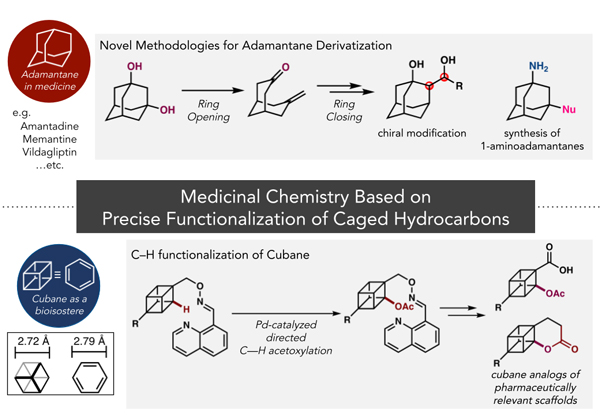
長澤翔太助教が寄稿した"かご型炭化水素キュバン・クネアンの創薬応用を志向した精密有機合成化学"が有機合成化学協会誌に掲載されました。
Movie
研究内容
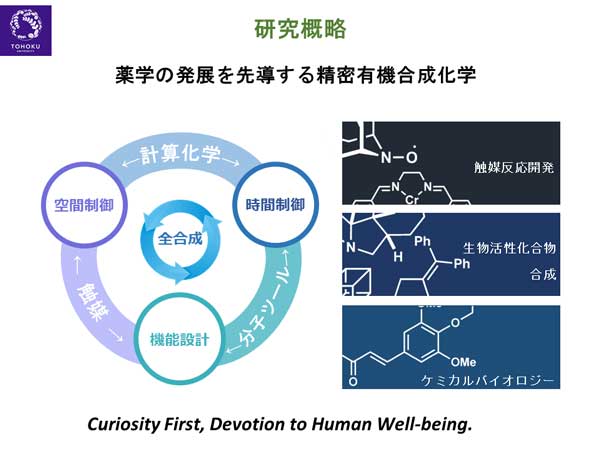
薬学の発展を先導する精密有機合成化学
岩渕研究室では、好奇心を大事に(Curiosity First)しながら、「薬学の発展を先導する精密有機合成化学」の研究に取り組んでいます。
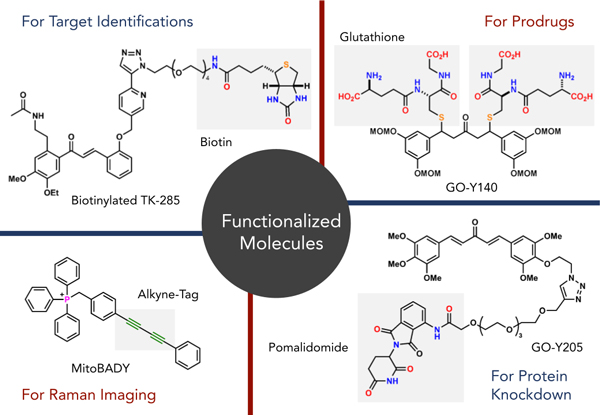
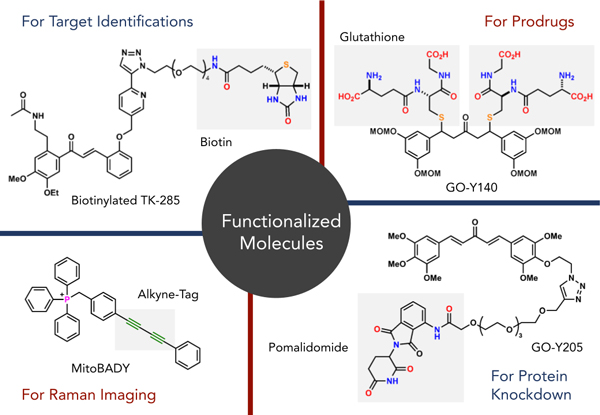
薬学における重要な分子の機能は生物活性です。そこで、岩渕研究室では生物活性化合物(主には天然物)の合成を中心的課題に設定しています。また、生物活性化合物や医薬品の効率的合成を可能にする触媒反応開発、生物活性化合物や医薬品の活性発現メカニズムの解明に迫る分子ツールの創出を介したケミカルバイオロジー研究を展開しています。
触媒反応開発では、反応の選択性制御、特に空間を制御した不斉触媒の開発を目指しています。また、分子ツールの開発では化合物がどこにどのように作用するのか、だけでなく、その経時変化(時間制御)の解明を目指します。これらの高難度空間制御、時間制御を実現するために、私たちは実験化学のみならず、コンピュータを用いた計算化学も活用して、効率的に研究を進めています。
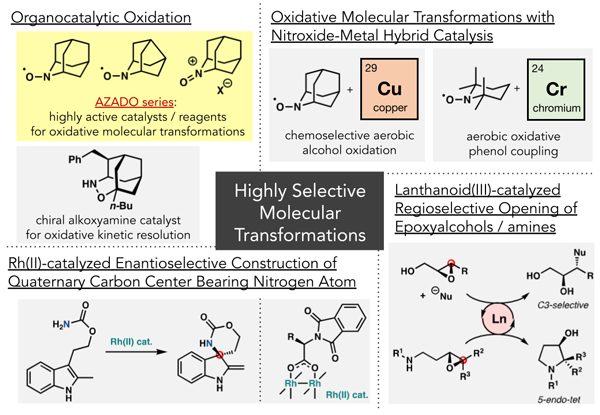
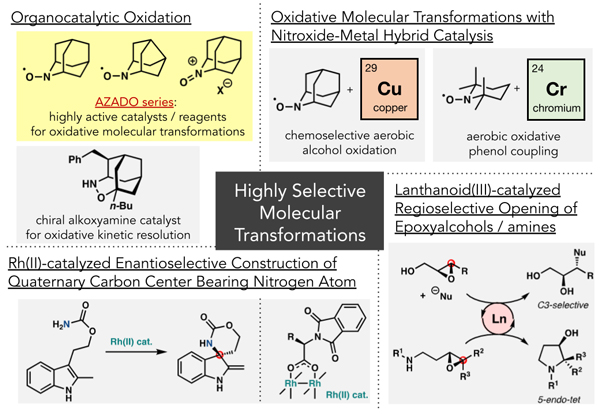
- ・有機分子触媒を用いる酸化反応
- ・有機分子-金属ハイブリッド触媒を用いる酸化的分子変換法
→ニトロキシルラジカル/銅触媒を用いる化学選択的アルコール空気酸化反応
→ニトロキシルラジカル/クロム触媒を用いる酸化的フェノールカップリング - ・キラルRh(Ⅱ)触媒を用いる含窒素不斉四置換炭素構築法
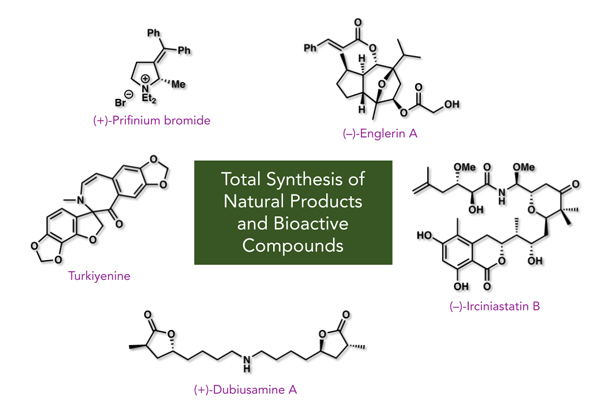
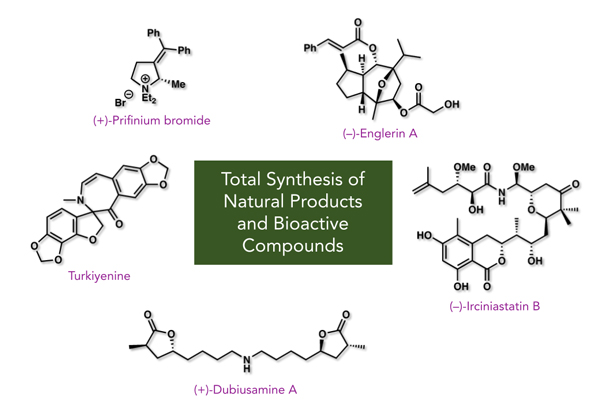
- 合成した天然物・医薬品
- ・Cytotrienin A (Angew. Chem. Int. Ed. 2023, e202303140, )
- ・Rumphellclovane E (Org. Lett. 2022, 24, 7572)
- ・(+)-Nemonapride (Chem. Pharm. Bull. 2017, 65, 22-24)
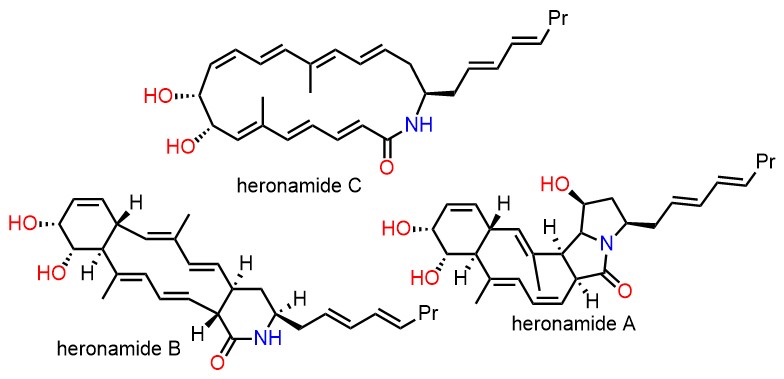
- ・Heronamides A-C (Chem. Eur. J. 2016, 22, 8586-8595)
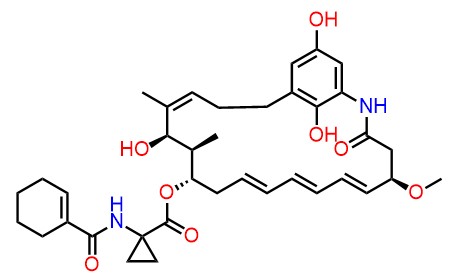
- ・FD-891 (J. Antibiot 2016, 69, 287-293)
- ・Turkiyenine (Proposed Structure) (Eur. J. Org. Chem 2016, , 270-273)
- ・Irciniastatins A (Psymberin) and B (J. Org. Chem 2015, 80, 12333-12350)
- ・(+)-Dubiusamine A (Org. Lett 2013, 15, 1788-1790)
- ・Sundiversifolide (formal synthesis) (Org. Lett 2011, 13, 3620-3623)
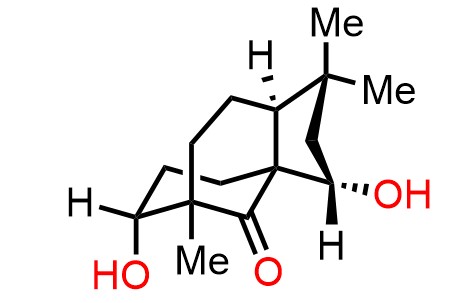
- ・Scabronine G (Org. Lett 2011, 13, 2864-2867)
- ・過去に合成した天然物


-Nemonapride.jpg)
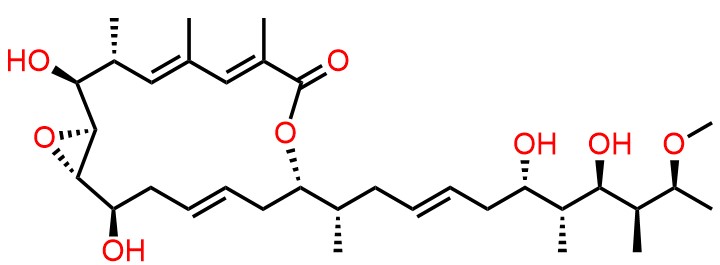
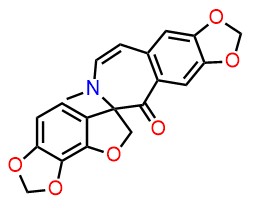
-IrciniastatinA.jpg)
-DubiusamineA.jpg)
-Sundiversifolide.jpg)
-ScabronineG.jpg)
-Idesolide.jpg)
-SalinosporamideA.jpg)
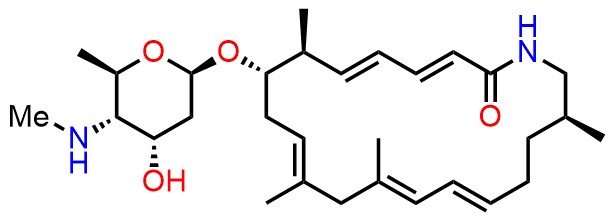
-CylindrocyclophaneA.jpg)
-Aspidospermidine.jpg)
-Martinelline.jpg)
-Juvabione.jpg)
-Dihydrocorynantheol.jpg)
-CP55_940.jpg)