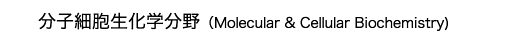![]()
1. 生理活性リゾリン脂質の新しい機能に関する研究
通常リン脂質は2本の脂肪酸を持ちますが、生体内には脂肪酸を1本しか持たないリン脂質が存在し、リゾリン脂質と呼ばれています。リゾリン脂質にはその構造の違いから様々な種類がありますが(図1)、ここ数年の間の発見から、細胞間、オルガネラ間の情報伝達物質として重要な役割があることが分かってきました。
|
|
|
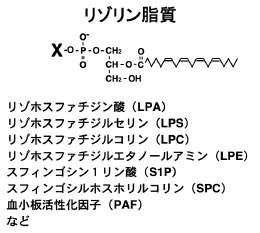
最近になって、これらのリゾリン脂質に対する特異的受容体が存在することが次々と明らかにされ(図2)、また、この受容体はロドプシン型のGタンパク質共役型受容体であることから、新しい創薬のターゲットとして注目を浴びています。
私達の研究室では、生理活性リゾリン脂質のうち、特に、リゾホスファチジン酸(LPA)、リゾホスファチジルセリン(LysoPS)に関して、その作用(受容体)・代謝(産生・分解酵素)の観点から世界のトップレベルの研究を目指し日々努力しています。さらに最新の手法を駆使し、新しい生理活性リゾリン脂質の発見を目指しています。
生理活性脂質リゾホスファチジン酸(LPA)
リゾホスファチジン酸(以下LPA)は、リン酸-グリセロール-脂肪酸という極めて単純な構造をもつリン脂質ですが、細胞増殖、血小板凝集効果、平滑筋収縮効果、がんの浸潤促進効果など非常に多岐にわたる薬理的作用を持っています。LPAは血清中に大量に存在し、血清が示す薬理作用の一部を担っていると考えられています。また、卵巣がん患者の腹水中に高濃度で存在し、がん細胞の増殖・浸潤を促進すること、血管平滑筋の増殖や形質転換を促進することから、がんや動脈硬化といった病態との関連も大いに注目されています。上述しましたように、LPAの作用は細胞表面のGタンパク質共役型受容体を介して細胞内に伝えられますが、私達のグループも含め、ここ数年の間に少なくとも3種類の受容体LPA1 (EDG2), LPA2 (EDG4), LPA3 (EDG7)が同定されました。これらの受容体は、互いに約50%の相同性を示し、5種類のスフィンゴシン1-リン酸(S1P)の受容体(EDG1, 3, 5, 6, 8, (S1P1-5))とともにendothelial differentiation gene (EDG) familyを形成しています。現在、受容体ノックアウトマウスが解析されはじめ、LPAの個体レベルでの機能が解明されつつあります。一方、LPAはリン脂質前駆体から何らかのメカニズムで産生されると考えられているが、その産生経路、さらには、LPA産生に関与する酵素(ホスホリパーゼ)の実体には不明な点が多く残されています。
1)リゾホスファチジン酸受容体LPA3 (EDG7) の機能解析
私達のグループは1999年に新しいタイプのリゾホスファチジン酸受容体LPA3(当初はEDG7と呼ばれていました)を発見しました(J. Biol. Chem. 1999)。最近、ノックアウトマウスを作製・解析した結果、LPA3が受精卵の着床に関与するという予想外の結果が得られました(Nature 2005)。LPA3のノックストマウスの子宮では受精卵の着床が正しく起きないため、子宮内で受精卵が均等に配列せず、分娩の延期、多胎妊娠が高頻度で起きます。このように、リゾホスファチジン酸というリゾリン脂質がLPA3という受容体を介して非常にユニークな機能を発揮していることが分かりました(図3)。
現在、少子化が社会的な問題となっておりますが、その背景で、晩婚、高齢出産の影響で不妊のカップルが激増しています。先進国では多かれ少なかれ、このような問題を抱えておりますが、そのような際、不妊治療が行われています。現在日本では、約60人に一人の赤ちゃんが不妊治療の助けを受け生まれています。しかし、不妊治療の成功率は約30%程度と低迷しており、その大きな原因は体外受精した受精卵を母の子宮に戻す際、着床がうまく行かないということです。
今回、リゾホスファチジン酸受容体LPA3が着床に関わるということが分かり、リゾホスファチジン酸が着床を促進していることが分かります。従って、LPA3受容体を選択的に活性化する物質は、着床を促進する薬になる可能性があります。私達の研究室では、国内外の有機化学者と共同研究し、LPA3選択的な作動薬を多数開発することに成功しています。近い将来、これらのLPA3選択的作動薬が着床改善薬になることを目標に研究を進めています。
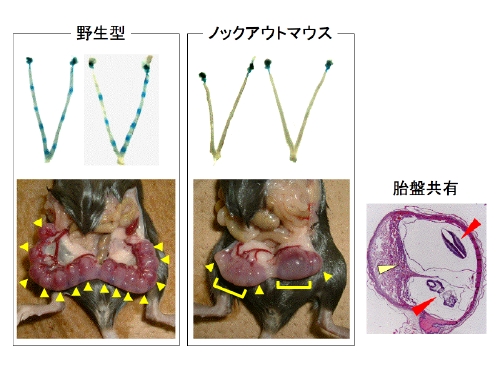 図3 LPA3ノックアウトマウスの着床異常と胎盤共有胎児の出現
図3 LPA3ノックアウトマウスの着床異常と胎盤共有胎児の出現
2)生理活性脂質リゾホスファチジン酸産生酵素リゾホスホリパーゼD
2−1)オートタキシンの発見
リゾホスファチジン酸は生体内では血液中に存在することが知られていました。また、いろいろな血液サンプルでのリゾホスファチジン酸の濃度が調べられ、循環血液中では非常に少ないのですが、血清や単離した血漿を加温した場合に急激に濃度が高くなることが分かっていました。私達はまず、この血液中のリゾホスファチジン酸ができる経路を詳細に解析し、血液中でのリゾホスファチジン酸産生にはいくつかの経路が存在することを明らかにしました(図4、J. Biol. Chem. 2002)。この研究により、血液中のリゾホスファチジン酸は2段階のステップで産生されることが分かりました。一つ目のステップは、血液中に存在するリン脂質がリゾリン脂質に変換される反応です。これには、sPLA2, PS-PLA1, LCATと呼ばれる複数のホスホリパーゼA1あるいはホスホリパーゼA2が関与していました。また、2段階目の反応は、1段階目でできたリゾリン脂質が、リゾホスホリパーゼDと呼ばれる酵素でリゾホスファチジン酸に変換されることが分かりました。このリゾホスホリパーゼDが血液中に存在することは1980年代に報告されていましたが、その分子の実体は明らかになっていませんでした。
私達は、ウシ胎児血清からこのリゾホスホリパーゼDを単離精製しその構造を決定しました。リゾホスホリパーゼDの本体は約100 kDaの糖タンパク質であり、この100 kDaの糖タンパク質のアミノ酸配列を決定したところ驚くべきことに、オートタキシントいう癌関連分子と同一であることが分かりました(J. Cell Biol. 2002)。オートタキシントはさまざまな悪性腫瘍に発現し、がん細胞に作用させるとがん細胞の運動性が著しく高まることから、悪性のがんの浸潤・転移に関与することが示唆されていた分子でした。以前から、リゾホスファチジン酸はがん細胞の増殖や運動を活発化させることが知られ、また、卵巣がん患者の腹水に高濃度のリゾホスファチジン酸が検出されることから、がんとの関連が示唆されていました。
オートタキシントは細胞の運動性だけでなく、増殖性も促進することも分かりました。高増殖能、高運動能の獲得はがん細胞の悪性度を規定する因子と考えられ、オートタキシントの「がん」における役割を考える上で重要な性質であると考えられます。悪性のがん細胞はオートタキシントを高発現しており、この様ながん細胞はLPAをオートクライン的に産生する能力を得ることにより増殖・浸潤能を獲得している可能性が提唱されました。LPAがsmall G protein であるRhoAやRac1 の活性化を介して細胞の運動性を促進していることはこれまでの多くの研究から証明されています。RhoAの活性化は、がん細胞の浸潤性と深く結びついており、オートタキシン(リゾホスホリパーゼD)やLPA受容体はその上流に位置づけられますので、がんの転移・浸潤を抑制するための恰好のターゲットだといえます。また、最近、オートタキシンやLPAがLPA1 (EDG2) 受容体を介して細胞の運動性を促進することを明らかにしました(J. Biol. Chem., 2004)。オートタキシンは悪性のリンパ腫であるホジキンリンホーマや最も悪性な脳腫瘍グリオブラストーマに高発現していて、これらの細胞の運動性をLPA1受容体を介して促進します(Blood, 2005, J. Biol. Chem., 2006)。このLPA1受容体アンタゴニストは抗癌剤になる可能性があり、現在、このような観点から新しいタイプの抗癌剤創製を目指しています。また、オートタキシンは病態マーカーとしての有用性に関する研究、ノックアウトマウスの解析を積極的に進めています。
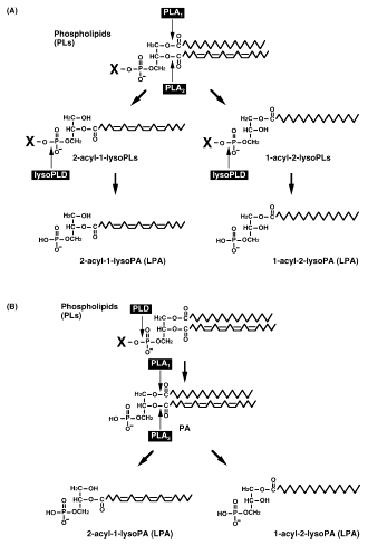 図4 リゾホスファチジン酸(LPA)の産生経路
図4 リゾホスファチジン酸(LPA)の産生経路
2−2)オートタキシンの生体内における機能
オートタキシンは生体内において血液、精液、卵胞液など体液に多く存在し、また脳、腎臓、リンパ節などにおいてその発現が高いが、オートタキシンが生体内においてどのような機能を有しているかは明らかになっていませんでした。そこで我々はオートタキシンノックアウトマウスの解析を行いました。その結果、オートタキシンノックアウトマウスは血管形成の異常により胎生致死であることが明らかとなりました (JBC 2006) 。オートタキシンノックアウトマウスでは胎児を包む羊膜上に血管が見られず、また胎児自身の血管形成にも異常が見られます(図5)。オートタキシンが胎生期において血管形成に重要な機能を担っていることが明らかとなりましたが、成体においてオートタキシンがどのような機能を有しているかは未だ不明のままであります。そこで現在、我々はオートタキシンのコンディショナルノックアウトマウス、過剰発現マウスを作製し、その成体における機能を探っています(図6)。
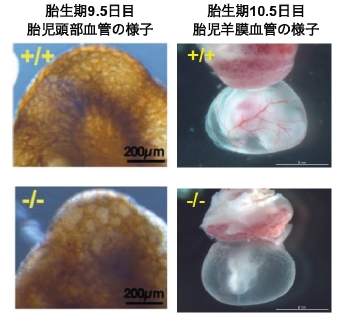 図5 オートタキシンのKOマウスは血管形成不全のため胎生致死となります
図5 オートタキシンのKOマウスは血管形成不全のため胎生致死となります
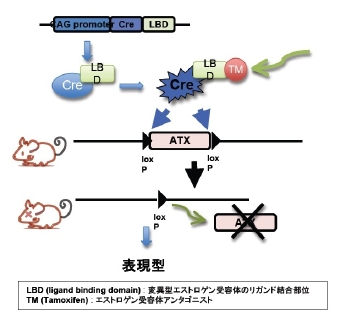 図6 オートタキシンの成体における機能を探るために必須なツールであるコンディショナルKOマウス
図6 オートタキシンの成体における機能を探るために必須なツールであるコンディショナルKOマウス
2−3)オートタキシンの病態における機能
オートタキシンは肝硬変などの種々の疾患でその血中濃度が上昇することがわかってきましたが、それら疾患におけるオートタキシンの機能は明らかにされていません。最近、LPAおよびその受容体LPA1が特発性肺線維症という難治性疾患に重要な機能を有することがHarvardのTagerらにより示されました (Nat med 2008) 。特発性肺線維症は肺間質部において線維芽細胞が浸潤、分化・増殖し、コラーゲンなどの細胞外基質を分泌することで、肺における酸素交換の著しい阻害がおき、5年生存率が30%というきわめて予後の悪い疾患であります。Tagerらが明らかにしたことは肺障害に伴ってLPAが肺間質に増え、ぞのLPAに対して線維芽細胞が遊走し、肺間質部に集積するということでありましたが、LPAがどのように産生されてくるかは不明でありました。我々は東北大学医学部との共同研究により、患者肺胞洗浄液中およびマウスモデルの肺胞洗浄液中にオートタキシンの発現が高いことを見いだしました。また個体内でオートタキシンを阻害するモノクローナル抗体を確立し、マウスモデルに投与したところ、肺の線維化の顕著な抑制が見られました。以上のことから、オートタキシンが肺線維化において重要な機能を有していることが明らかとなり、現在、確立したモノクローナル抗体の医薬化に向けて研究を進めています(図7参照)。
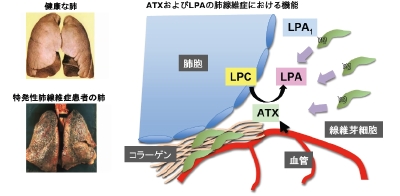 図7 オートタキシンはLPAを産生し、難治性疾患肺繊維症を引き起こす
図7 オートタキシンはLPAを産生し、難治性疾患肺繊維症を引き起こす
3) リゾホスファチジン酸と体毛形成
最近、ヒトの先天性貧毛症の原因遺伝子として、PA-PLA1α/LIPHが同定された。この遺伝病患者は生まれつき体毛が少ない病態(貧毛)や体毛が極度に縮れた形態(縮毛)を示します。PA-PLA1αは我々の解析により、細胞外へ分泌され細胞膜へ結合する酵素であり、リン脂質のうちホスファチジン酸(PA)に対してホスホリパーゼA1(PLA1)活性を示し、LPAの産生酵素として機能しうるとが判っていました。さらにごく最近、同様の先天性貧毛症・縮毛を示す別の家系の解析から、P2Y5が原因遺伝子として同定されました。P2Y5は内在のリガンドが不明のGタンパク質共役型受容体(GPCR)であり、アミノ酸配列上LPA受容体のLPA4やLPA5に最も高い相同性を示します。従って、体毛形成時においてPA-PLA1αの産生するLPAがP2Y5へと受け渡すメカニズムが働いており、このLPAシグナルに異常が生じることで体毛形成の異常が起こることが示唆されました(図8)。実際、我々はP2Y5がLPAにより活性化されることや、PA-PLA1αが細胞膜上のPAからLPAを産生してP2Y5を活性化することを見出し、PA-PLA1α-LPA-P2Y5の経路が働くことを、培養細胞レベルで見出しています。さらに、PA-PLA1αの遺伝子欠損マウスを作製したところ、体毛が縮れることがわかりました。PA-PLA1aは体毛の成熟を促進する特定の層で働いていることや、P2Y5の下流のシグナルでEGF受容体が機能していることを見出しています。P2Y5に対するアゴニストは体毛形成促進薬として機能すると想定されており、我々は様々なLPA構造類似体を用いて、培養細胞レベルでP2Y5への反応性が見られるか、さらにPA-PLA1αの遺伝子欠損マウスに投与した時に体毛異常が改善されるかを指標に育毛薬の開発を行っています。
図8 LPA/ホスファチジン酸特異的ホスホリパ-ゼA1を介する毛包成長
4)新規リゾリン脂質受容体の同定
リゾリン脂質は細胞に対し様々な応答を引き起こす。この最初のステップはリゾリン脂質の受容体への結合である。リゾリン脂質は脂肪酸とともに親水性の高いリン酸基を有しており、細胞膜を通過できないため、受容体は形質膜上に存在すると考えられていた。実際、これまでにリゾリン脂質の受容体が10種類以上同定されているが、これらはすべてGタンパク質共役型受容体(G protein-coupled receptor, GPCR)と呼ばれる1群のファミリーに属する。GPCRは細胞膜を7回貫通するという特徴的な構造を持っており、ヒトゲノム中には700から800程度存在し最大のファミリー遺伝子を形成する。市販されている薬剤の約半数はGPCRに作用して機能を発揮することから、GPCRの研究は創薬の観点からも非常に重要視されている。GPCRの中の半数以上は、内在の作用物質(リガンド)がわかっておらず、オーファンGPCRと呼ばれている。これらオーファンGPCRには、リゾリン脂質受容体が多数含まれていると考えられている。リガンドを同定することは、リゾリン脂質の生体内における機能を明らかにする第一歩である。GPCRの活性化は様々な下流のシグナル(細胞内カルシウム流入、cAMPの増減、レポーター遺伝子の発現など)を検出することにより測定できる。我々は最近、下流のシグナルとして膜型プロテアーゼの活性化を指標にした検出系を確立した。この検出系は高感度であり、一般的なシグナル経路とは異なることや、適応できるGPCRの範囲が広いことから、これまでに見出されていないGPCRのリガンド同定が可能ではないかと期待している。
5)ゼブラフィッシュを用いたリゾリン脂質の生体内作用機構・機能の解析
私達の研究目的の一つは、リゾリン脂質が生体内で“どのような機構で”、“どのような機能を有するか”を明らかにすることです。私達はこの問題に挑戦するため、マウス以外にもゼブラフィッシュを用いた解析を進めています。ゼブラフィッシュは、ペットショップで容易に手に入る飼育が簡単な熱帯魚です。体外で速やかに発生が進行し、胚が透明であるため胚発生過程の観察が容易であること、および遺伝学的操作が容易という特徴を有し、様々な生命現象を in vivo で観察できるモデル生物として近年注目を集めています(図9)。主なリゾリン脂質シグナル関連遺伝子は魚類以上の高等生物にのみ高度に保存されていることから、ゼブラフィッシュはリゾリン脂質シグナル経路の解明に有効なモデル生物と考えられます。私達はリゾホスファチジン酸(LPA)を含む、様々なリゾリン脂質関連遺伝子(受容体、産生酵素、分解酵素、細胞内シグナル分子など)について、それらの遺伝子のゼブラフィッシュにおける機能、並びに各遺伝子の相互作用機構を明らかにし、個体におけるリゾリン脂質シグナル経路の全容解明を目指します。その解析には、分子生物学、生化学、細胞生物学を始め、遺伝学、薬理学、生物有機化学の手法を用います。得られた知見を元に、最終的にリゾリン脂質およびそのシグナルをターゲットとした魅力的な創薬につなげることを目指します。
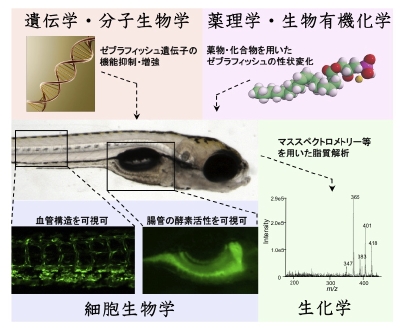 図8 ゼブラフィッシュと脂質生物学
図8 ゼブラフィッシュと脂質生物学
生理活性脂質リゾホスファチジルセリン
5) ホスファチジルセリン(PS)特異的ホスホリパ-ゼA1(PS-PLA1)
マスト細胞は、アレルギーの病態に深く関与する細胞です。病態時には、マスト細胞の細胞表面にはアレルゲン特異的なイムノグロブリンE (gE)がIgE受容体を介して結合しており、アレルゲンに暴露されるとIgE受容体が架橋されこれが引き金となっていわゆる脱顆粒反応が引き起こされます。マスト細胞の顆粒内には、ヒスタミンやセロトニンなどのケミカルメディエーターが貯蔵されており、これらのケミカルメディエーターが最終的にアレルギーを引き起こします。リゾホスファチジルセリン(lysoPS)は、肥満細胞活性化能力を有する新しいリン脂質性のメディエ-タ-です(図10)。しかし、その産生・作用メカニズムはほとんど分かっていませんでした。我々は、ホスファチジルセリン(PS)に特異的に作用しlysoPSを産生する酵素の精製・遺伝子クロ-ニングを行いこの酵素をホスファチジルセリン特異的ホスホリパ-ゼ(PS-PLA1)と命名しました(J. Biol. Chem. 1997)。これまでの解析から、本酵素は、lysoPSの産生を介し、肥満細胞の活性化を著しく促進すること(J. Biol. Chem. 2001)、様々な炎症刺激でその発現が誘導され、炎症反応部位に検出されること、などが分かっています。本プロジェクトでは、PS-PLA1ノックアウトマウス、過剰発現動物を用い、PS-PLA1の生体内での位置づけを明らかにすることを目標に研究を進めています。また、細胞生物学、分子生物学的手法を駆使し、lysoPS受容体のクロ-ニングを目指している。lysoPSの産生・作用のメカニズムの解明を通じアトピ-性皮膚炎などを代表とするアレルギ-疾患への寄与が期待されます。また、PS-PLA1を標的とした抗アレルギー薬の開発を製薬企業と共同で進めています。
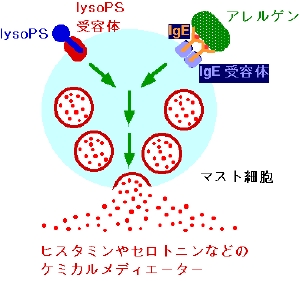 図10 マスト細胞の活性化とlysoPS
図10 マスト細胞の活性化とlysoPS
2. ユニークなホスホリパ-ゼ分子の解析
1)新規NPP family 分子の機能解析
上述した、LPA産生酵素、オートタキシン/リゾホスホリパーゼDには、ファミリー分子が存在します。これまで、NPP1-7の計7種類の遺伝子が同定されています(図11)。このうち、基質特異性が解析されていなかったNPP6の機能解析を生化学的に行いました。NPP6はリゾホスファチジルコリン、グリセロホスホコリンなどに作用し、リゾホスホリパーゼC活性を持っていることが示されました(J. Biol. Chem. 2005)。この酵素は、腎臓の近位尿細管など、特殊な細胞に発現しています。細胞・個体レベルで解析を進めています
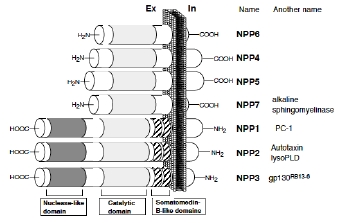 図11 NPPファミリー分子の構造
図11 NPPファミリー分子の構造
2)細胞内型ホスホリパーゼA1の機能解析
ホスホリパーゼA1はリン脂質のsn-1位に結合した脂肪酸を加水分解する酵素ですが、その機能はほとんど分かっていません。最近、我々のグループを含めいくつかのグループから、細胞内型のホスホリパーゼA1が報告されました。細胞外のホスホリパーゼA1と異なり、細胞内型ホスホリパーゼA1は進化的によく保存されており、腫を超えて普遍的な機能を持っていうものと予想されます。最近開発されたsiRNAを用いた遺伝子干渉法、線虫をの遺伝子改変個体の解析を通じ、細胞内型ホスホリパーゼA1の新規機能を解明しようとしています。