研究内容(2020~): 現在・未来
新学問領域「バリアーシステムズ生物学(Barrier Systems Biology)」の構築と中枢関門創薬への応用
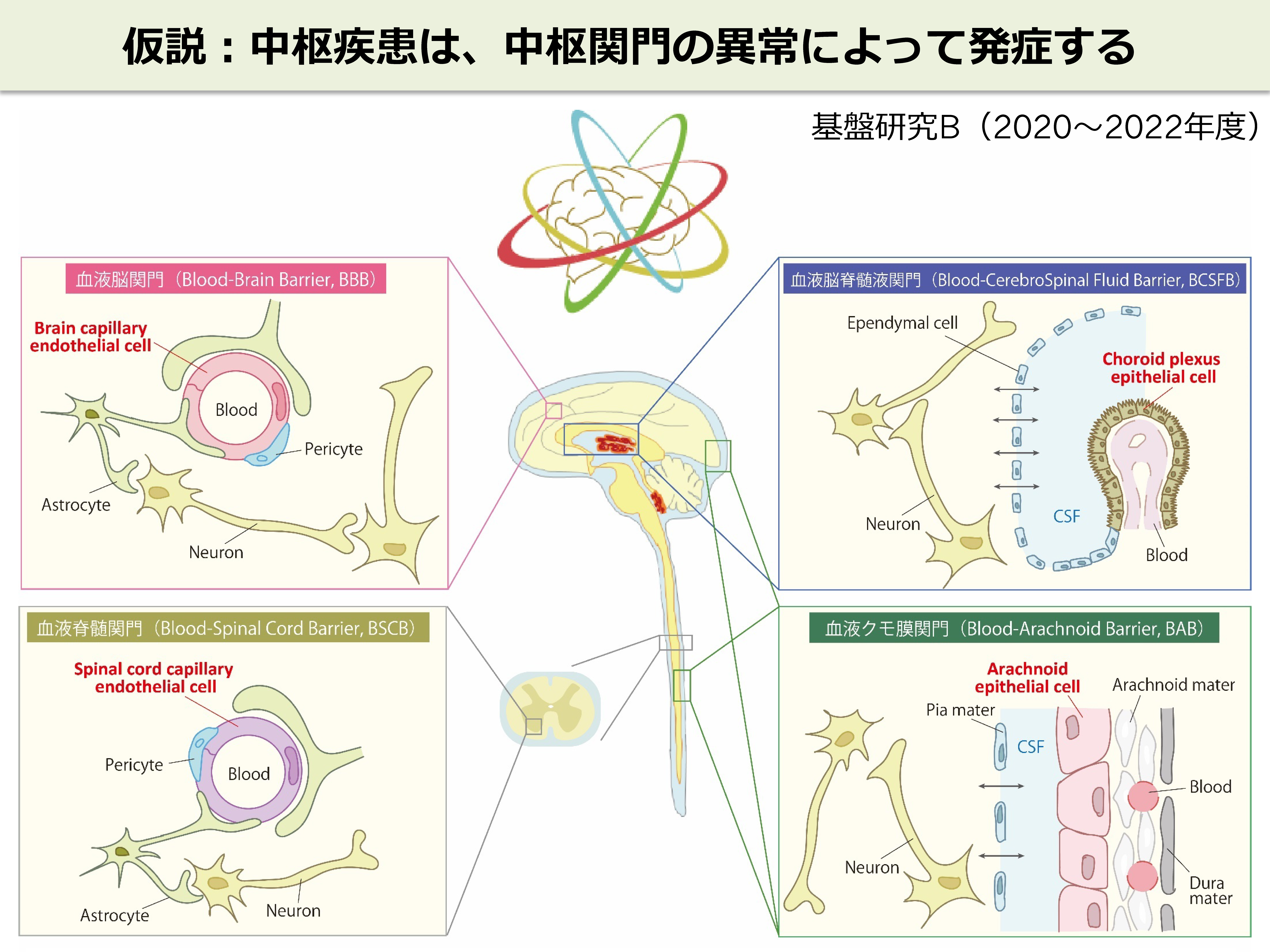
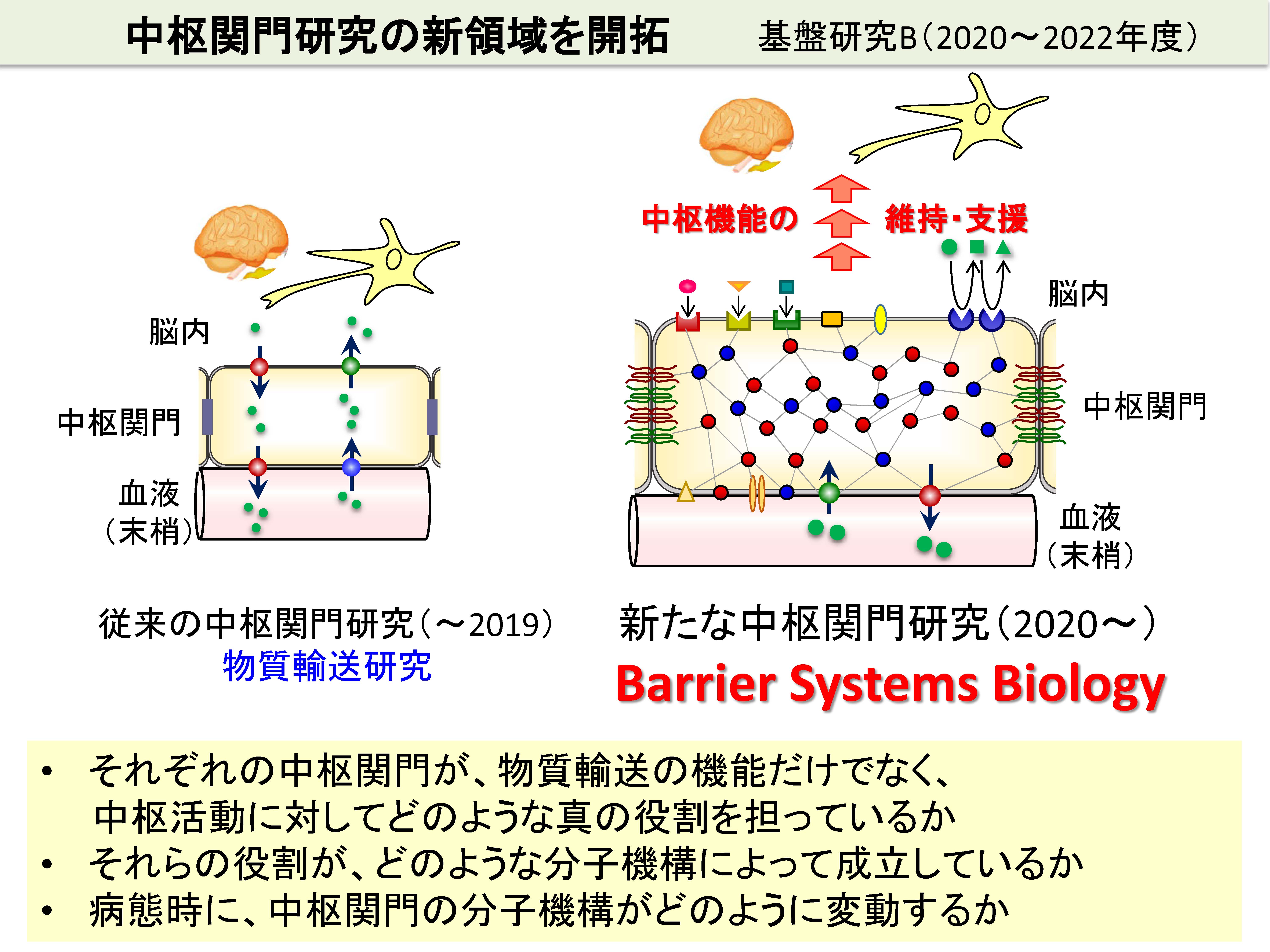
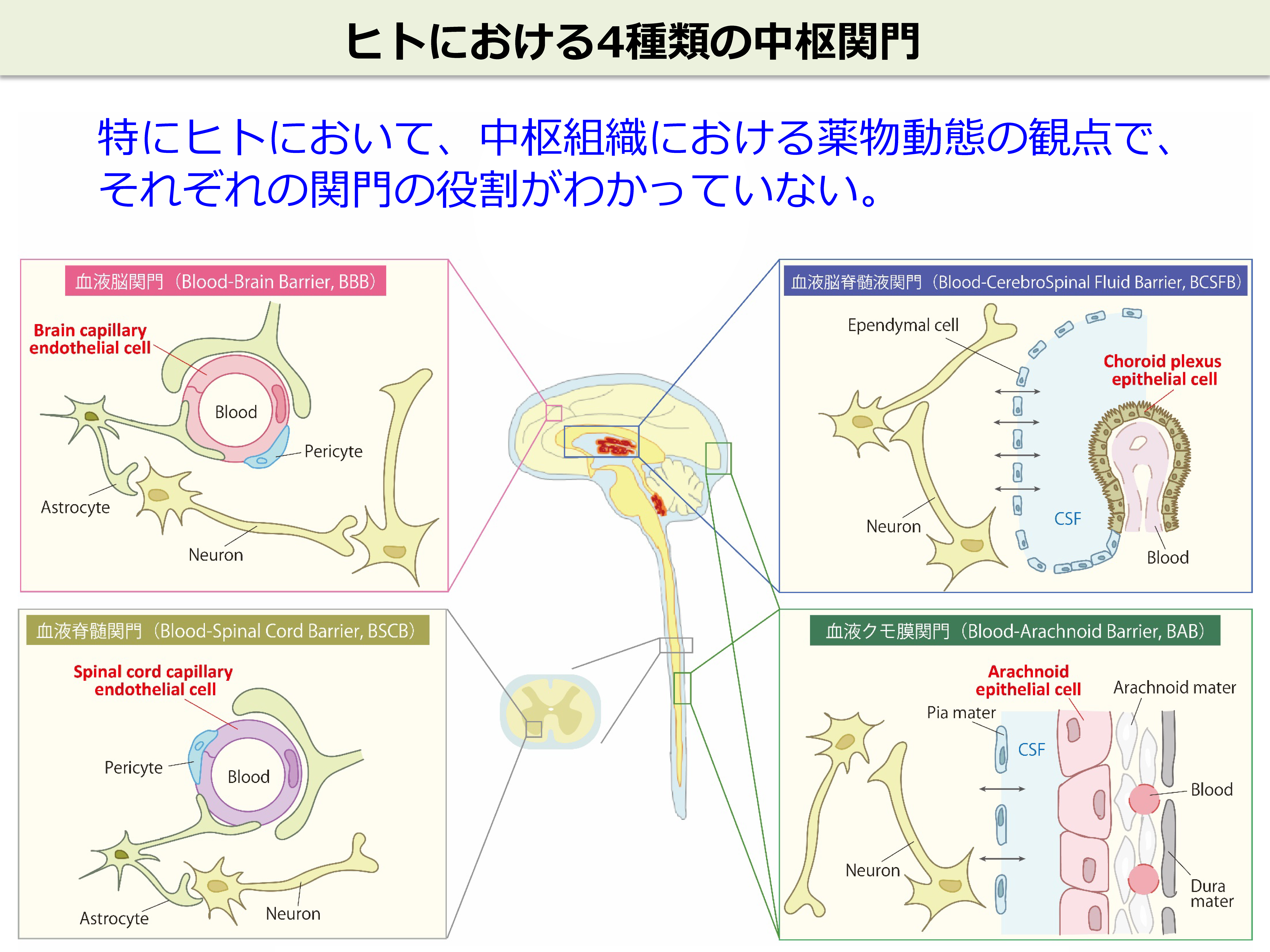
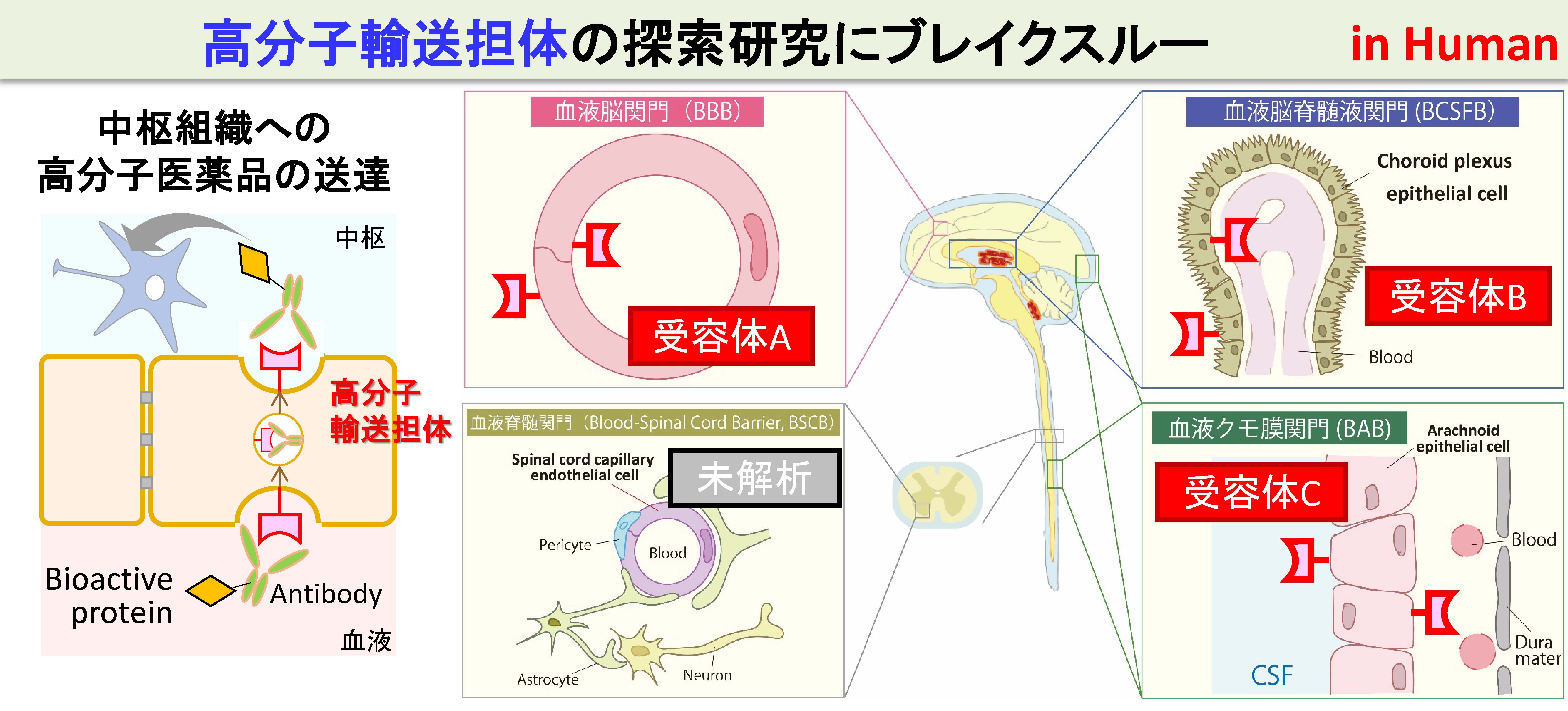
中枢組織には、血液脳関門(BBB)に加えて、血液脳脊髄液関門(BCSFB)、血液クモ膜関門(BAB)の4種類の関門組織が存在します。これらをまとめて中枢関門と呼びます。4種類の中枢関門は、単なる中枢組織を守るバリアーではなく、中枢の活動を積極的に支援していると我々は考えています(研究室のロゴマークはこれを表しています)。従って、中枢疾患は、この支援機構の破綻、すなわち中枢関門の異常によって発症すると我々は仮説立てています。
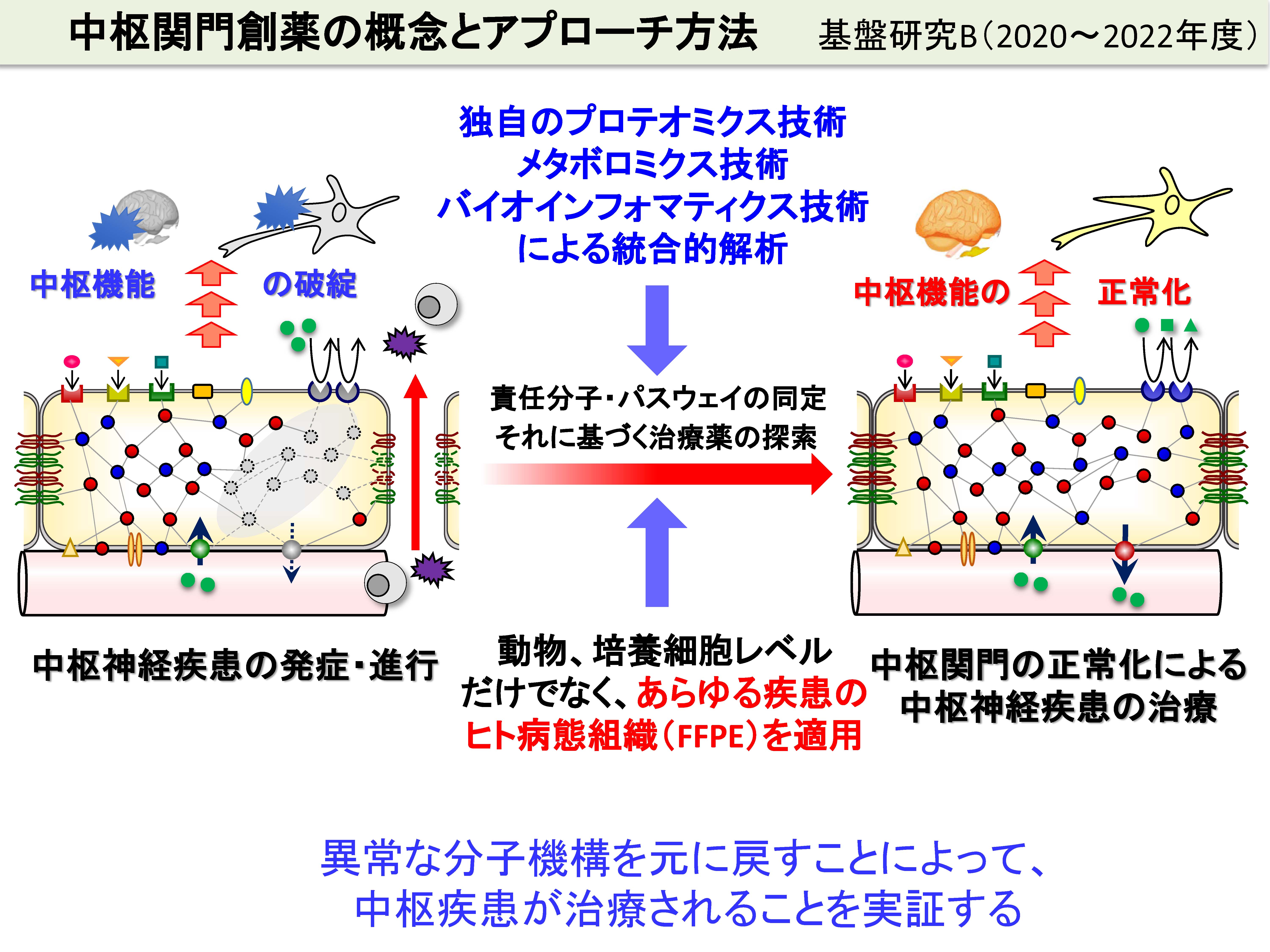
低迷する中枢疾患治療薬の新薬開発に突破口を拓く上で、新しい創薬フィールドの創出は重要な課題です。中枢関門を標的とした創薬の例は過去にありません。我々は、中枢関門が中枢疾患の原因となるという仮説を証明し、中枢関門を標的とした薬物治療によって中枢疾患が改善することを実証したいと考えて研究に取り組んでいます。この研究を達成することによって中枢関門創薬の基盤を構築し、あらゆる中枢疾患に対する新薬開発の突破口を拓きたいと考えています。
この実現には、従来の、物質輸送を主たる対象とした中枢関門研究では不十分です。それぞれの中枢関門が、物質輸送の機能だけでなく、中枢活動に対してどのような真の役割を担っているか。それらの役割が、どのような分子機構によって成立しているか。病態時に、中枢関門の分子機構がどのように変動するか。これらをシステマティックに解明していく、新しい中枢関門研究「バリアーシステムズ生物学(Barrier Systems Biology)」を立脚することが重要であると考えています。
ヒトの中枢疾患部位のホルマリン固定組織は、医療機関にたくさん保管されています。後述のように、このホルマリン固定(FFPE)組織を用いて、我々は、中枢関門におけるどのような分子機構が病態の原因であるかを解析しています。分子機構を解明するために、独自のプロテオミクス技術(後述)、メタボロミクス技術およびバイオインフォマティクス技術を統合的に使用しています。また、無数の化合物の中から、病態分子機構を元(正常)に戻すための化合物を選択するためのオミクス技術も開発しています。これらの最先端技術を組み合わせることによって、あらゆる中枢疾患における中枢関門の異常分子機構を同定し、治療薬を選定し、中枢関門を正常化することによって、中枢疾患が治療されることを実証したいと考えて研究に取り組んでいます。
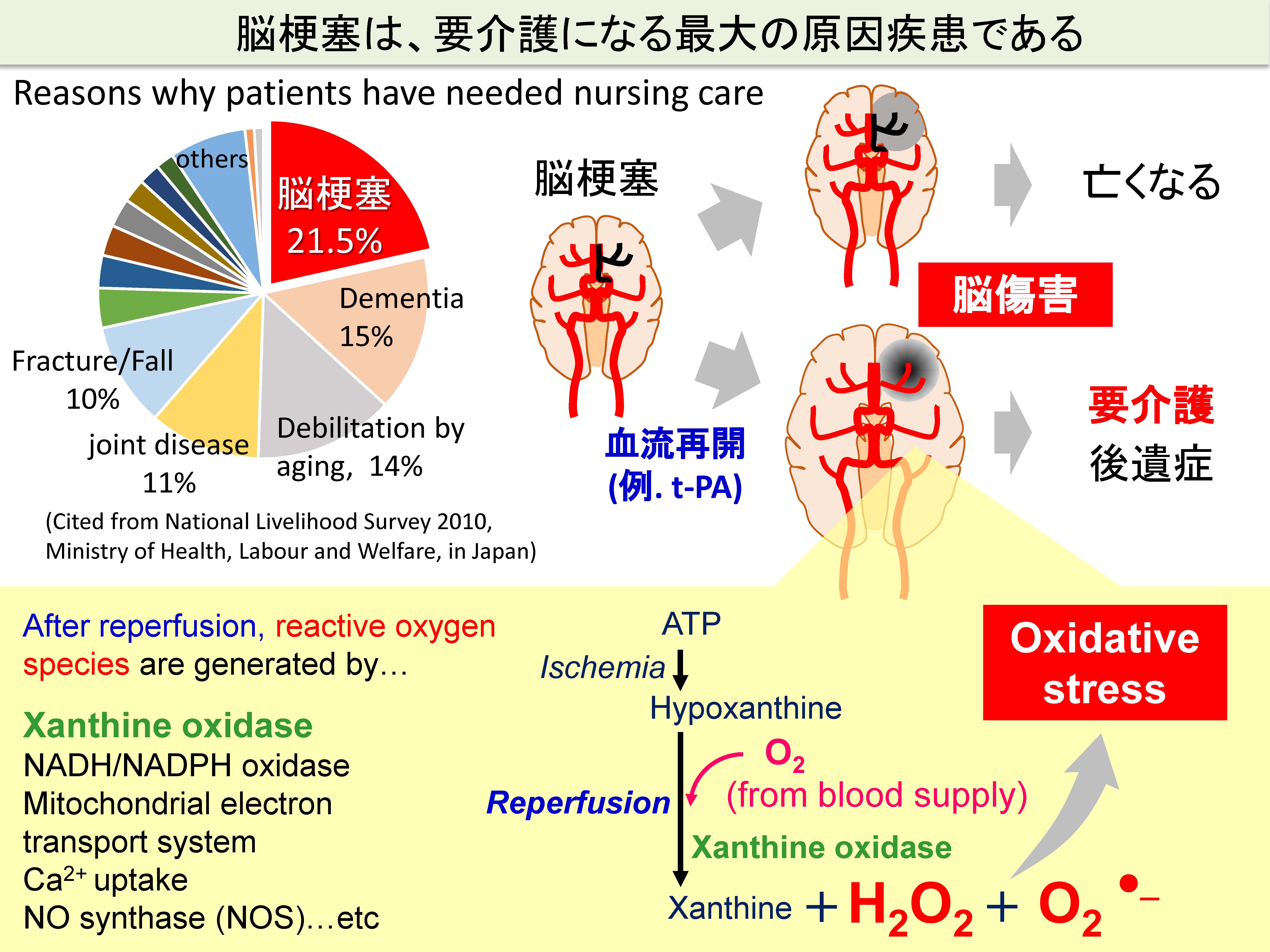
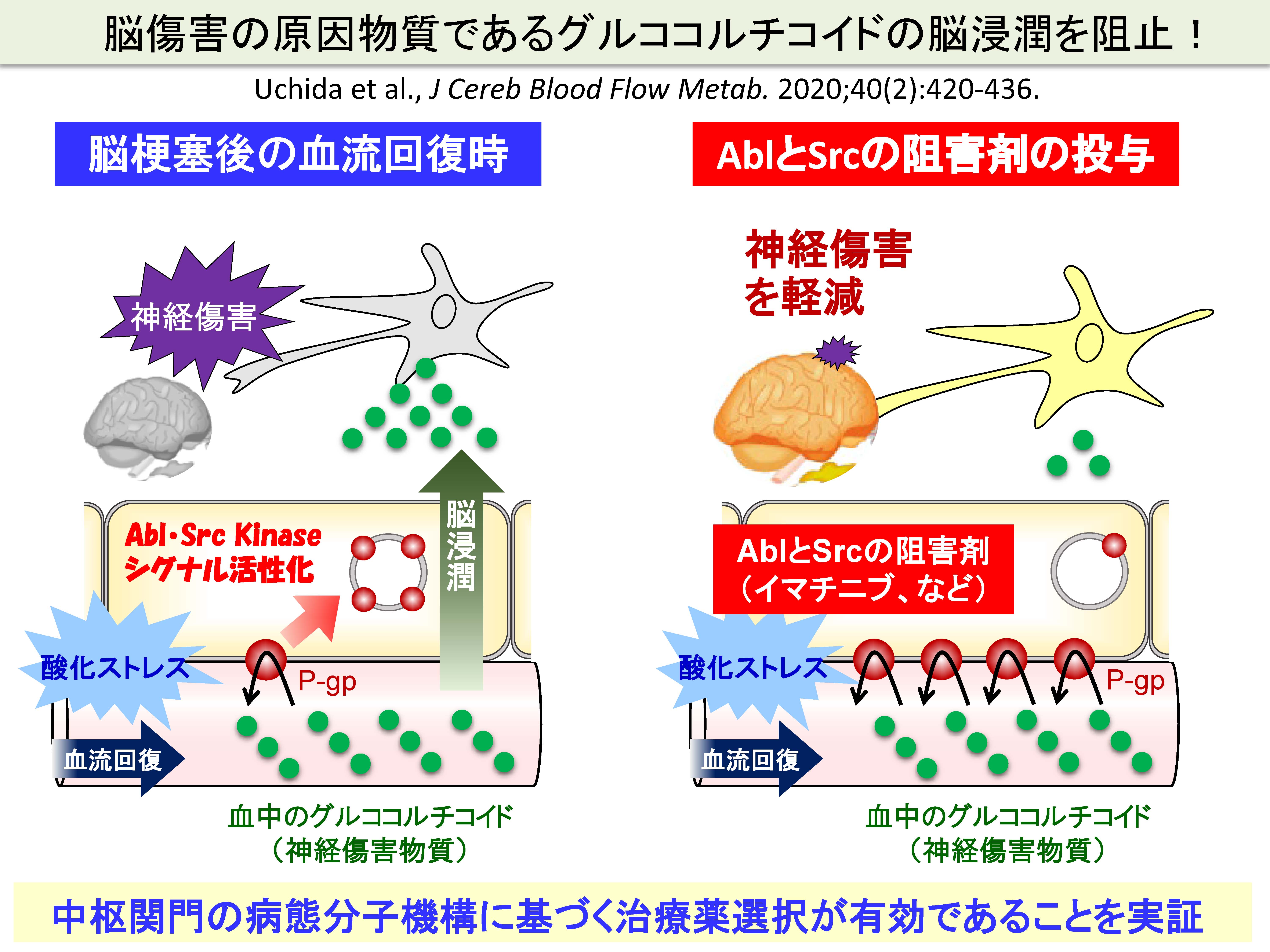
成功例としては、脳梗塞の新規治療薬の創出があげられます。脳梗塞は、罹患後に後遺症を最も負いやすい疾患であり、要介護になりやすい疾患です。脳梗塞直後の血流再開療法によって、一命はとりとめることができるようになったものの、その血流の再開によって周辺の脳組織が傷害を受けます。原因としてさまざまな分子機構が報告されていますが、我々は、血流再開に伴って発生する酸化ストレスによって神経障害物質であるグルココルチコイドが大量に脳内へ移行し、神経障害が生じることに着目しました。我々の研究の結果、酸化ストレスの発生に伴って、AblキナーゼおよびSrcキナーゼが活性化され、異物排出トランスポーターであるP糖タンパク質(P-gp)が細胞内へ内在化し、これによってグルココルチコイドの脳への移行量が増大すること、を明らかにしました。さらに、AblキナーゼおよびSrcキナーゼの阻害剤を予め投与しておくと、P-gpの内在化が起きないため、グルココルチコイドの脳浸潤が阻止されること(P-gpによって積極的に排出されること)を明らかにしました。このように、中枢関門の病態分子機構に基づく治療薬選択が有効であることを次々と実証していくことによって、中枢関門創薬の基盤を構築していきたいと考えています。
独自の研究手法を用いて薬物動態研究の新領域を切り拓く
ヒトのトランスポーターファミリーは、ABC, SLC、MFSファミリーなどに大別され、約500種類存在します。しかし、そのほとんどの分子がどのような機能をもっているのか、どのような物質を輸送するのかはわかっていません。GPCRなどの他の遺伝子ファミリーに比べて研究が最も遅れている分野です。すでに機能解明されているSLCトランスポーターの多くは、疾患の原因や有効な創薬標的となっていますので、トランスポーターファミリーを開拓する研究は、今後のライフサイエンス研究の突破口を拓くと期待されます。
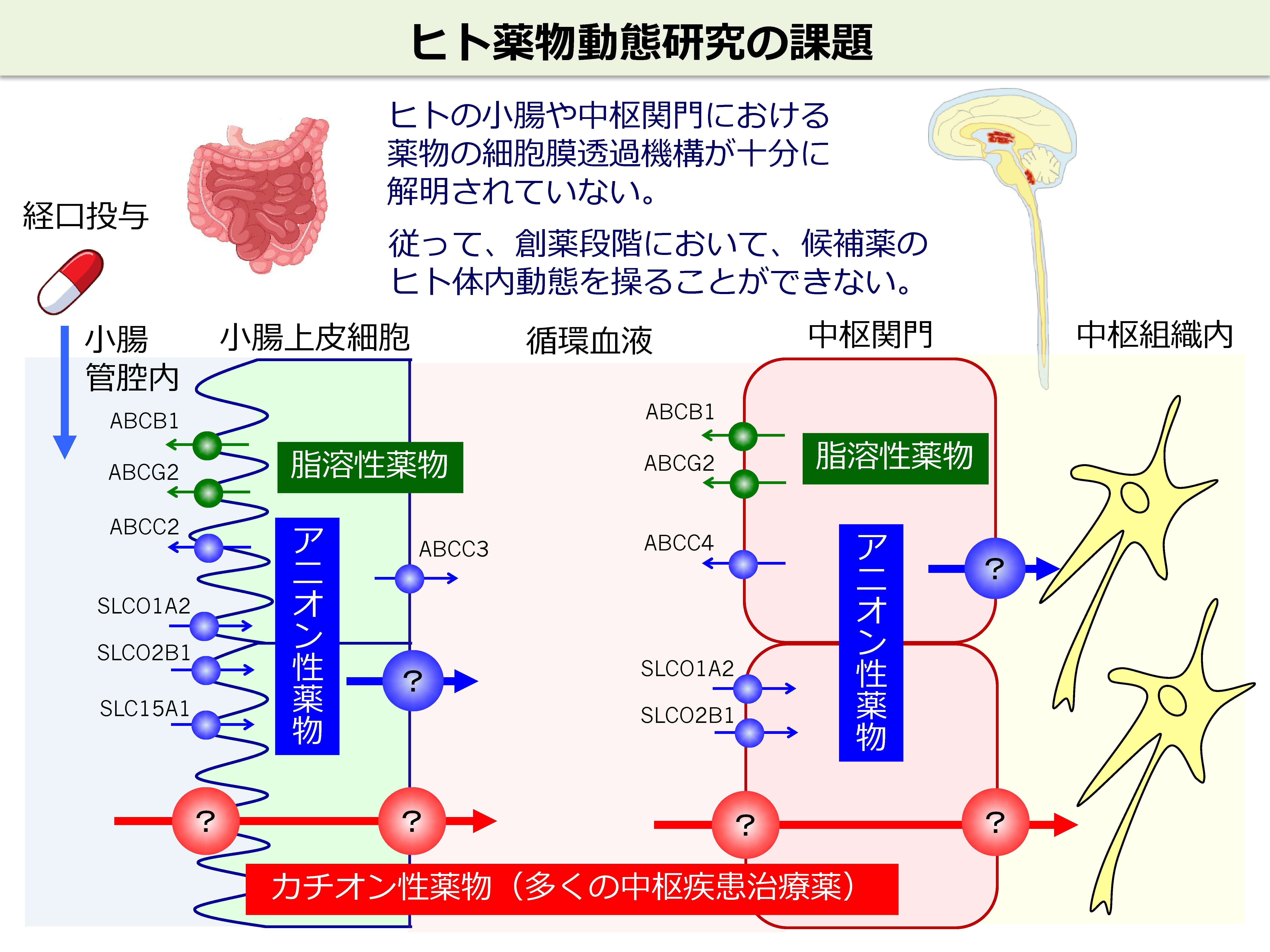
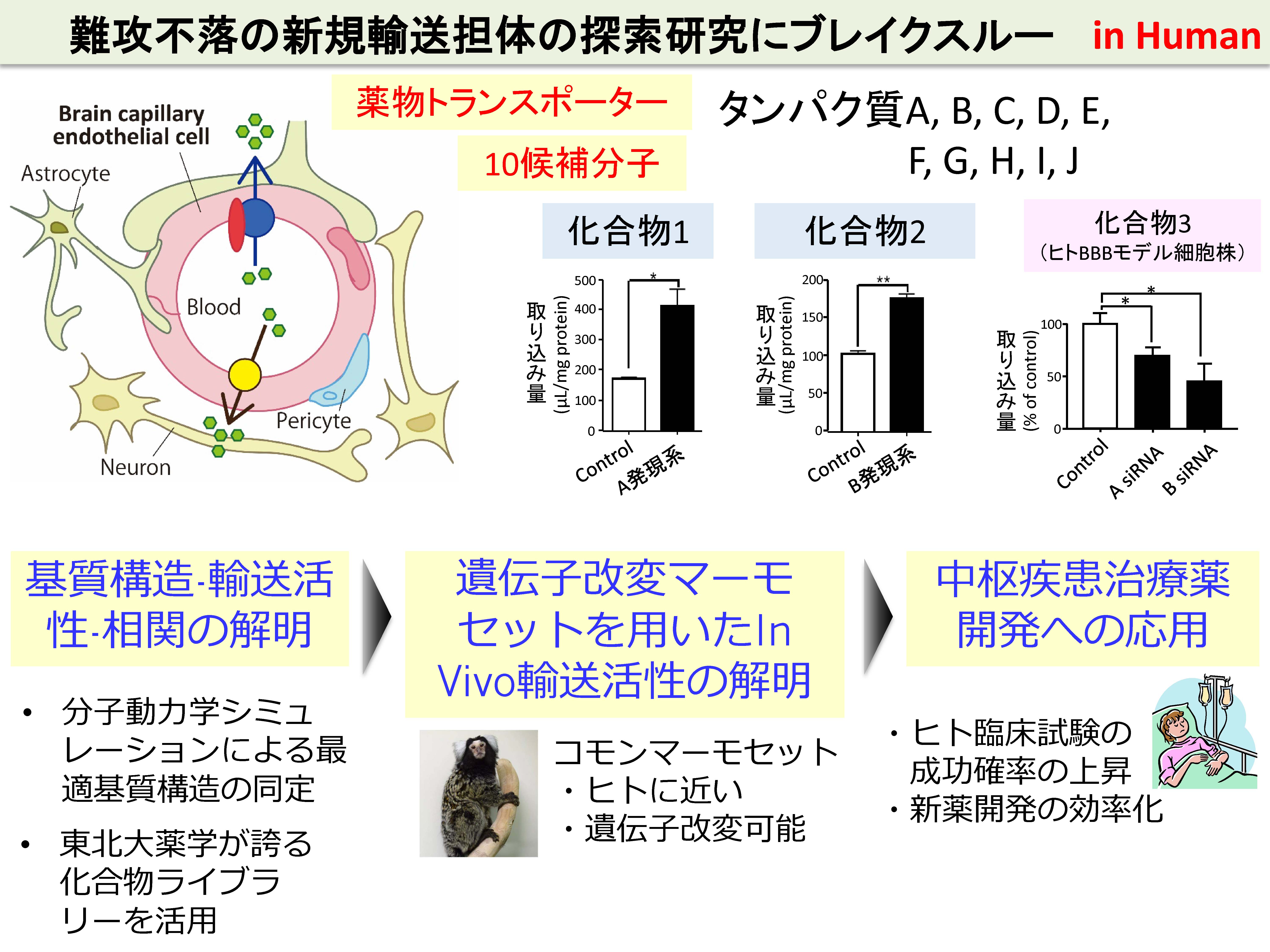
中枢疾患治療薬の開発を考える場合、中枢へ移行しやすい候補化合物を見出すことが重要です。消化管吸収および中枢関門の透過において、どのようなトランスポーターが関与しているかを理解し、うまくそれらトランスポーターに輸送される候補化合物をスクリーニングすることが有効な手段です。げっ歯類では、その透過機構もわかってきていますが、げっ歯類とヒトでは発現するトランスポーターの種類や量が異なることから、ヒトでどんなトランスポーターがどれくらいの量や輸送活性をもって発現しているかを知ることが待ち望まれています。特に、中枢疾患治療薬の多くは、カチオン性薬物であることから、ヒトの小腸と中枢関門において、有機カチオン性薬物を輸送するトランスポーターの存在を発見し、その特性を解明することが重要な課題の一つです。
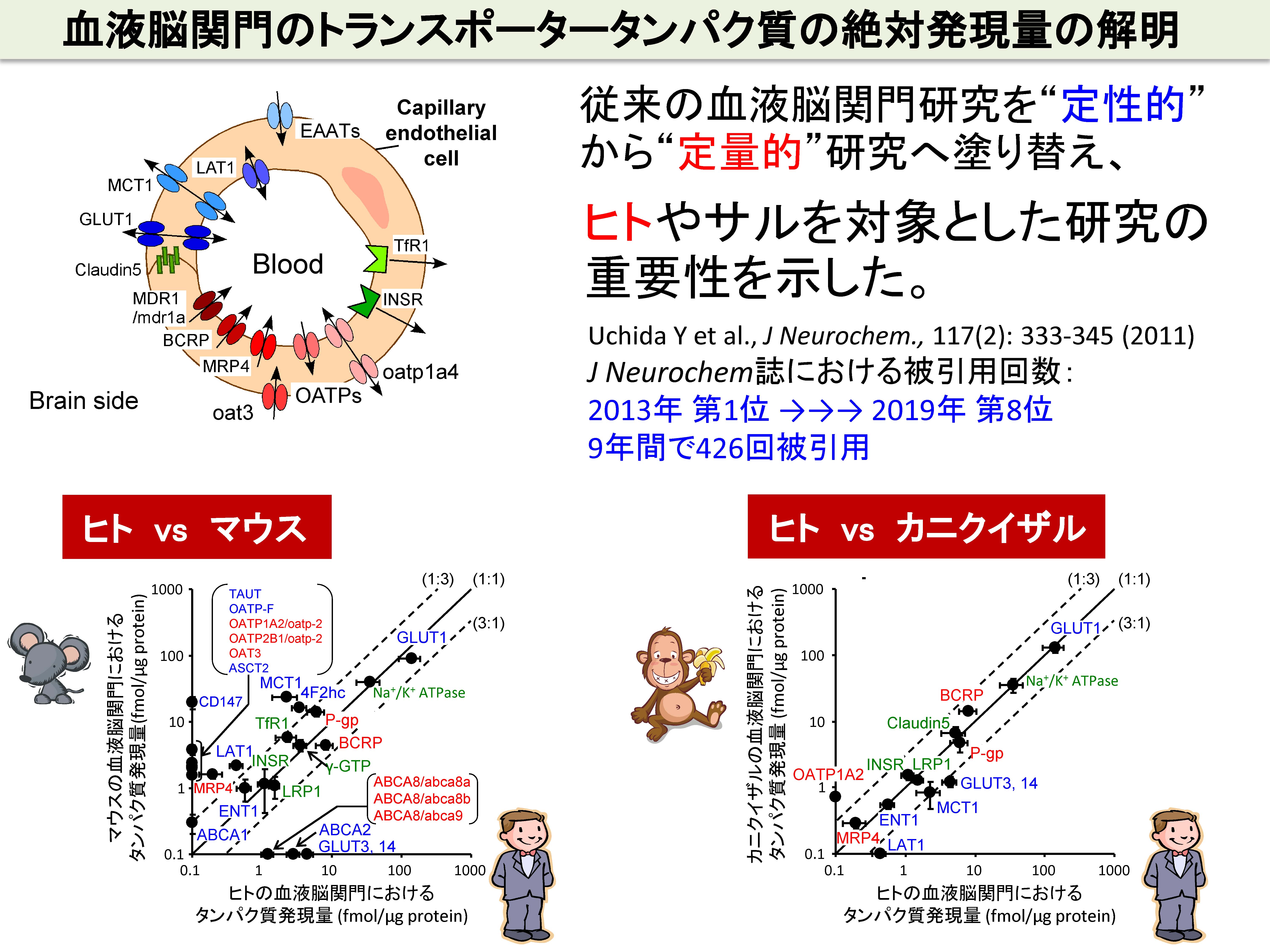
中枢には、4種類の関門組織が存在します。血液脳関門、血液脳脊髄液関門、血液脊髄関門および血液クモ膜関門です。これらは、中枢の異なる部位において、末梢からの薬物の中枢組織への移行の障壁となっています。中枢組織への薬物の移行を考えるうえでは、それぞれの中枢関門に、どのような化合物を輸送するトランスポーターが、どれくらいの量で、どちら向きの輸送方向(末梢→中枢、あるいは中枢→末梢)をもって発現しているか、を理解する必要があります。げっ歯類の血液脳関門の性質はよく解析されていますが、我々は、この従来型の研究では限界があり、ヒトレベル、そして4種類の関門を統合的に解析することこそが新領域を拓く上で重要と考えて研究を行っています。
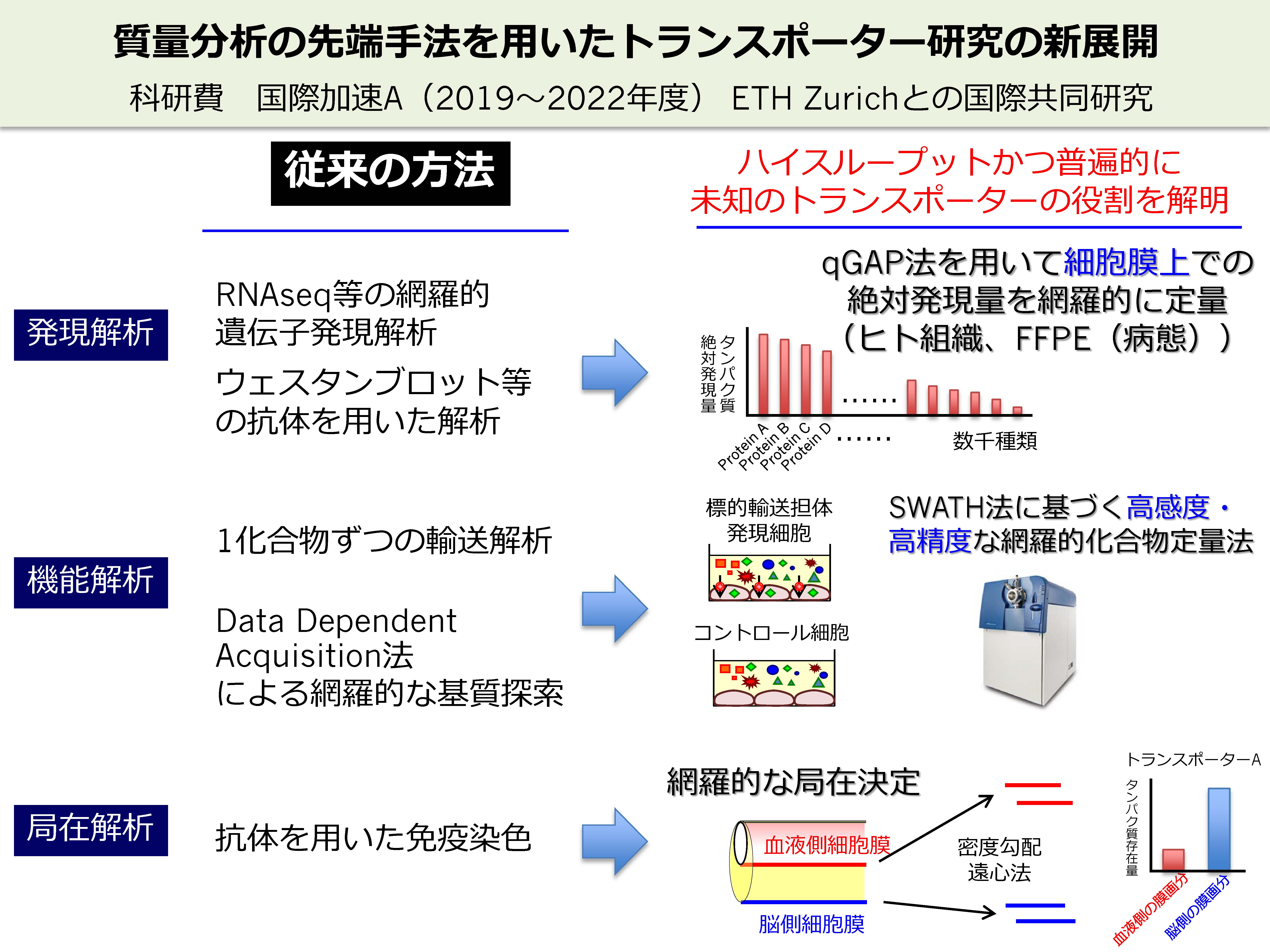
新領域の開拓のためには、新たな技術・アプローチ方法が必須と考えています。我々は、独自開発したqGAP法(後述)を用いて、細胞膜上でタンパクレベルで高発現するトランスポーター候補を網羅的に探索しています。候補トランスポーターの発現量の異なる細胞に複数の化合物を取り込ませ、取り込み量の違いから輸送基質を同定し、候補トランスポーターの役割を明らかにしています。さらに、抗体を用いることなく、定量プロテオミクス技術によって複数のトランスポーターの細胞膜局在(輸送方向)を網羅的に決定しています。このように、ハイスループットかつ普遍的に未知のトランスポーターの役割に迫るアプローチ方法が有効と考えて研究を行っています。
すでに興味深いトランスポーター候補が同定されており、最終的に、創薬や臨床応用を目指して研究を行っています。トランスポーターだけでなく、タンパク質や遺伝子などの高分子を輸送できるトランスサイト―シス型受容体の候補も、それぞれの中枢関門で同定されており、高分子医薬品の中枢への供給経路として期待されます。
ヒトの生体内で病気の組織における分子機構を解明するためには、どのようなアプローチが必要か?
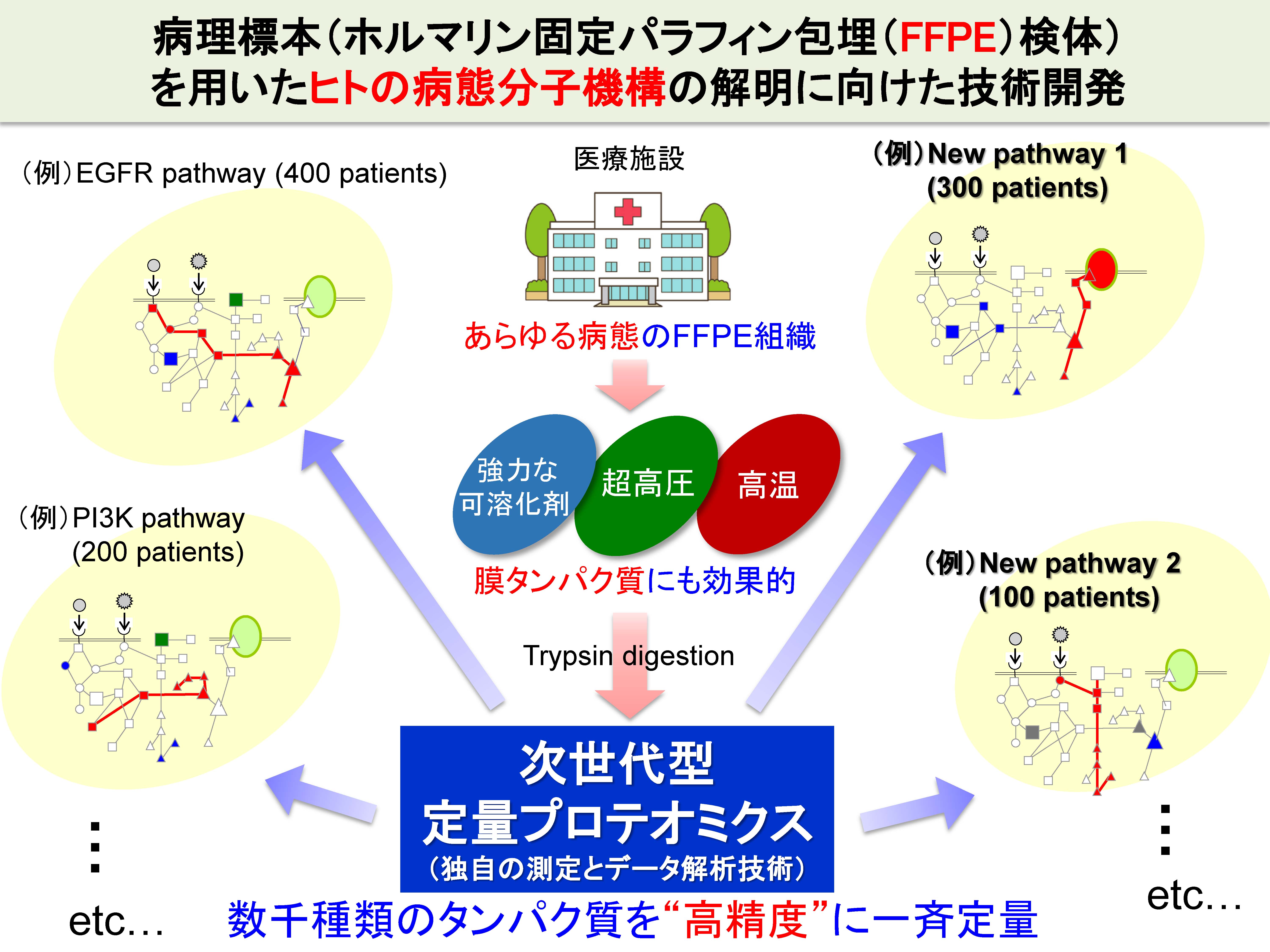
創薬研究において、ヒトの生体内で起こっている疾患の分子メカニズムを解明し、それを理解したうえで新薬開発を行うことが王道だと考えられます。しかし、ヒトの病態組織(新鮮、凍結の組織)を十分量入手することは困難です。ホルマリン固定したヒト病態組織(ホルマリン固定パラフィン包埋組織;Formalin Fixed Paraffin Embedded(FFPE)tissue)は医療機関にたくさん保管されており、大変魅力的ではありますが、現状は病理診断の用途に限られており、分子機構の解明の目的には利用できない、などという大きな課題がありました。このため、疾患モデル動物・培養細胞などを用いた実験系が幅広く利用されてきていますが、これらモデルはヒトの真の病態を反映していないという根本的な問題を抱えています。
我々は、直接的にヒトの病態分子機構を解明するためには、ヒトの病態組織を対象とした研究が必須であると考え、医療機関に豊富に保管されている「FFPE組織」の利用が最も有用であると考えました。
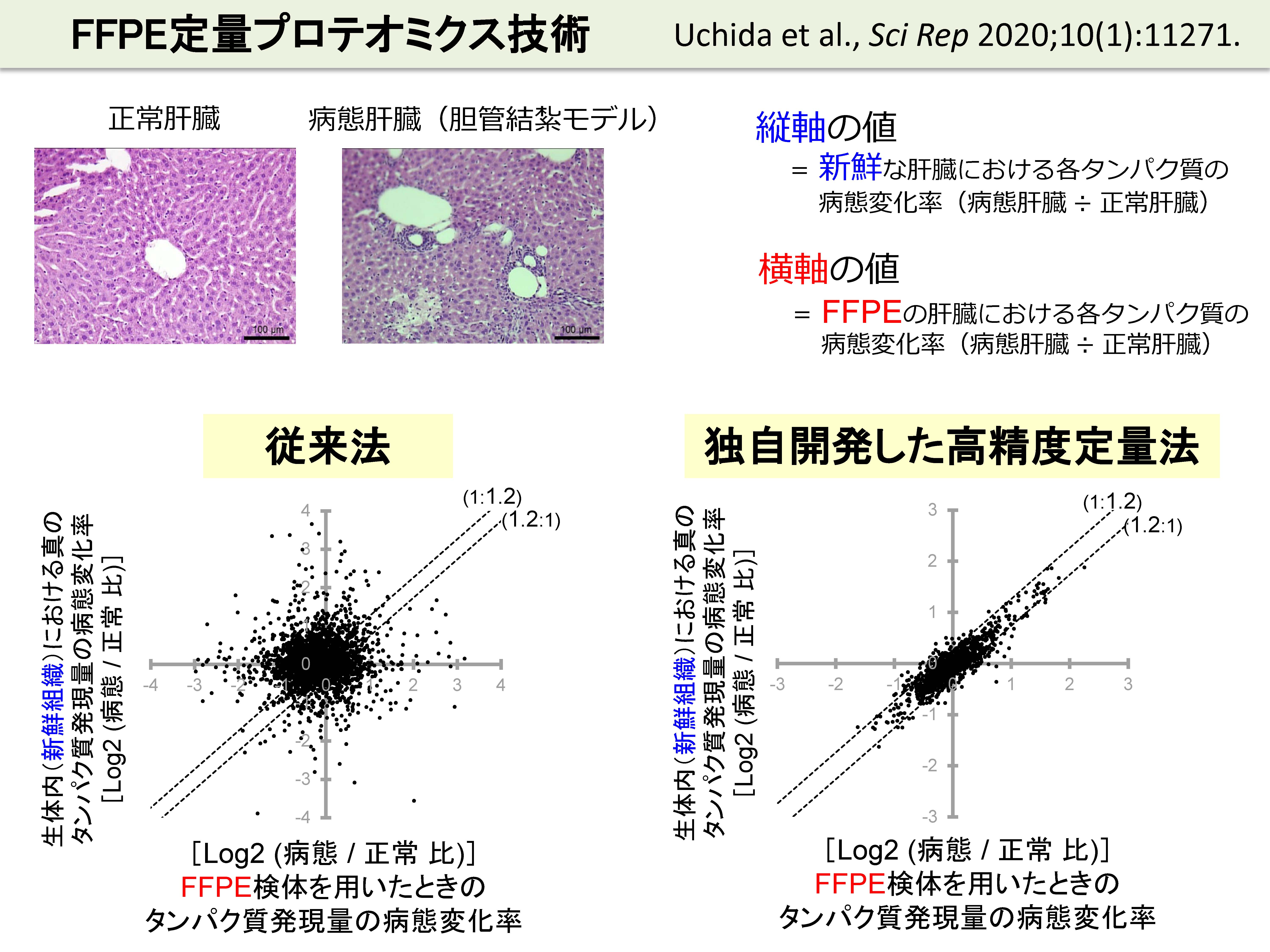
FFPE組織に対してプロテオミクス技術を適用できれば、病態分子機構を解明するための突破口が開かれます。しかし、FFPE組織内では、あらゆる生体分子は、ホルマリン架橋によって互いに密に共有結合しているため、従来法では、FFPE組織から効率よくタンパク質を抽出することは困難でした。これに対して、我々は、超高圧、高温および強力な可溶化剤を組み合わせることによって、FFPE組織から高効率でタンパク質(抽出が困難な膜タンパク質も)を抽出できる方法を開発しました。高精度な網羅的定量プロテオミクス技術(SWATH法)を組み合わせることによって、組織からのタンパク抽出からタンパク質の定量までの一連の過程を高精度化することに成功しました。すなわち、生体内で生じている分子機構をそのまま丸ごと(ロスなく)抽出でき、定量できるようになったため、病態と正常のFFPE組織を用いて得られた各タンパク質の病態変化率(病態/正常比)が、生体内(新鮮組織)の病態変化率を極めて良好に反映するようになりました。下図の従来法のグラフと比べると一目瞭然です。
世界中の医療機関には、膨大な数のFFPE組織が臨床情報と紐づいて保管されています。従って、下図のように、ある疾患について、複数の患者のFFPE組織検体を処理することによって、疾患の分子メカニズムの全容が解明され、新薬開発の新たな標的分子・パスウェイの発見につながると期待されます。また、患者ごとの病態分子機構の診断に基づく、オーダーメイド医療への応用も視野に入れています。
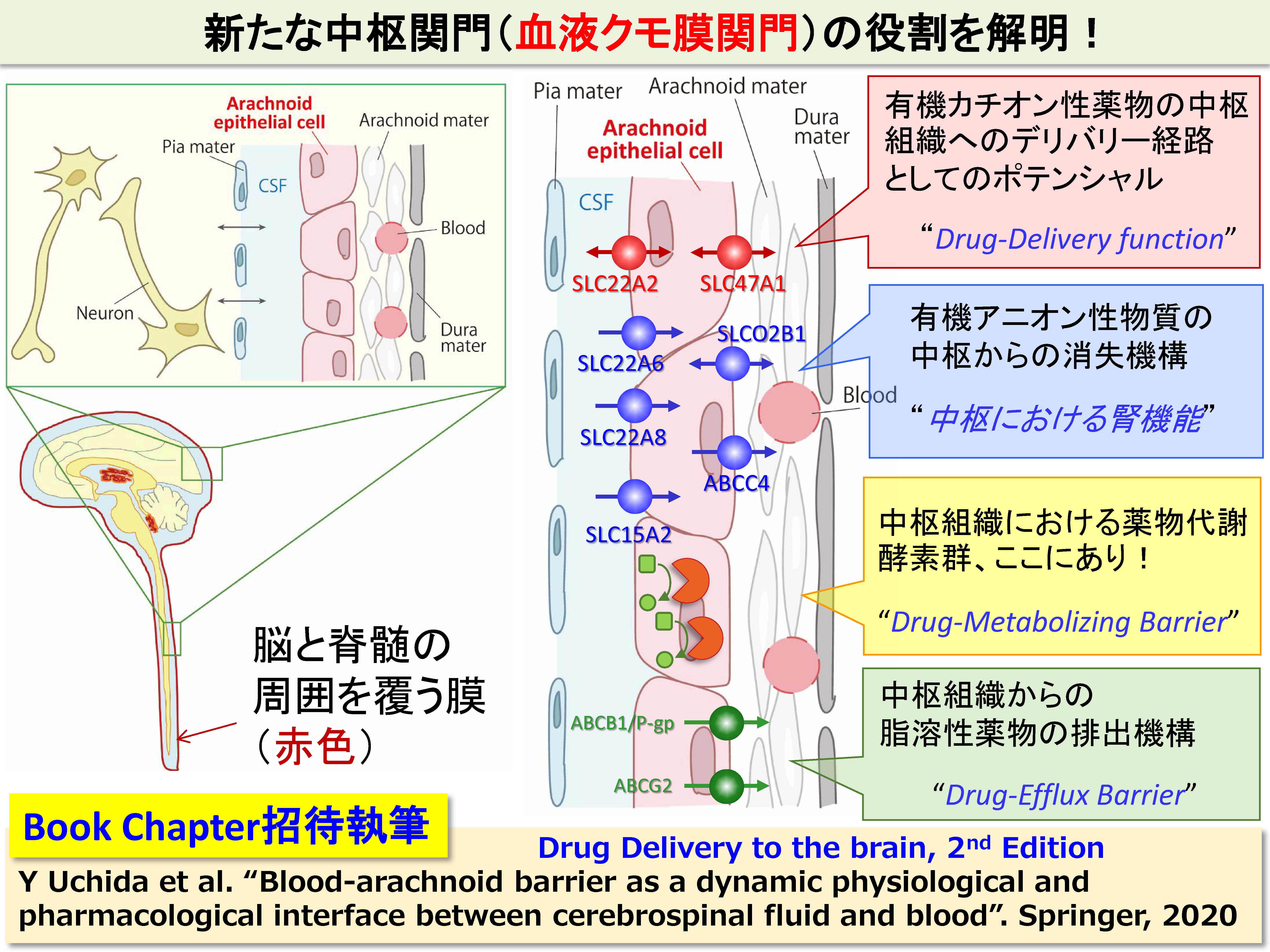
新たな中枢関門(血液クモ膜関門)の役割を解明!
中枢の関門といえば、血液脳関門が良く知られていますが、これ以外にも複数の関門組織が古くから知られています。しかし、その機能や役割は不明なものが多いです。血液クモ膜関門は、中枢組織の外周、具体的には脳脊髄液の外側を覆う関門組織です。実態は、クモ膜上皮細胞(Arachnoid Epithelial Cell)が互いに密着結合を形成することによって、脳脊髄液(中枢)側と循環血液(末梢)側を隔てています。旧来は、単なる物質透過の障壁と考えられてきましたが、我々は、網羅的定量プロテオミクス技術を用いて、この血液クモ膜関門に様々な種類のトランスポーター、受容体や酵素群が発現していることを一挙に解明し、下図に示したような様々な役割をもつユニークな関門であることを示唆しました。ヒトの血液脳関門では、有機カチオン性薬物および有機アニオン性薬物を輸送するトランスポーター群は、軒並み検出限界以下の低い発現量ですが、血液クモ膜関門は下図のようなトランスポーターを高発現しています。また、薬物代謝酵素も豊富であり、中枢の薬物動態を考えるうえでは、無視することができないユニークな関門であると考えて研究に取り組んでいます。
既存の薬剤学の枠を超えた研究を目指して
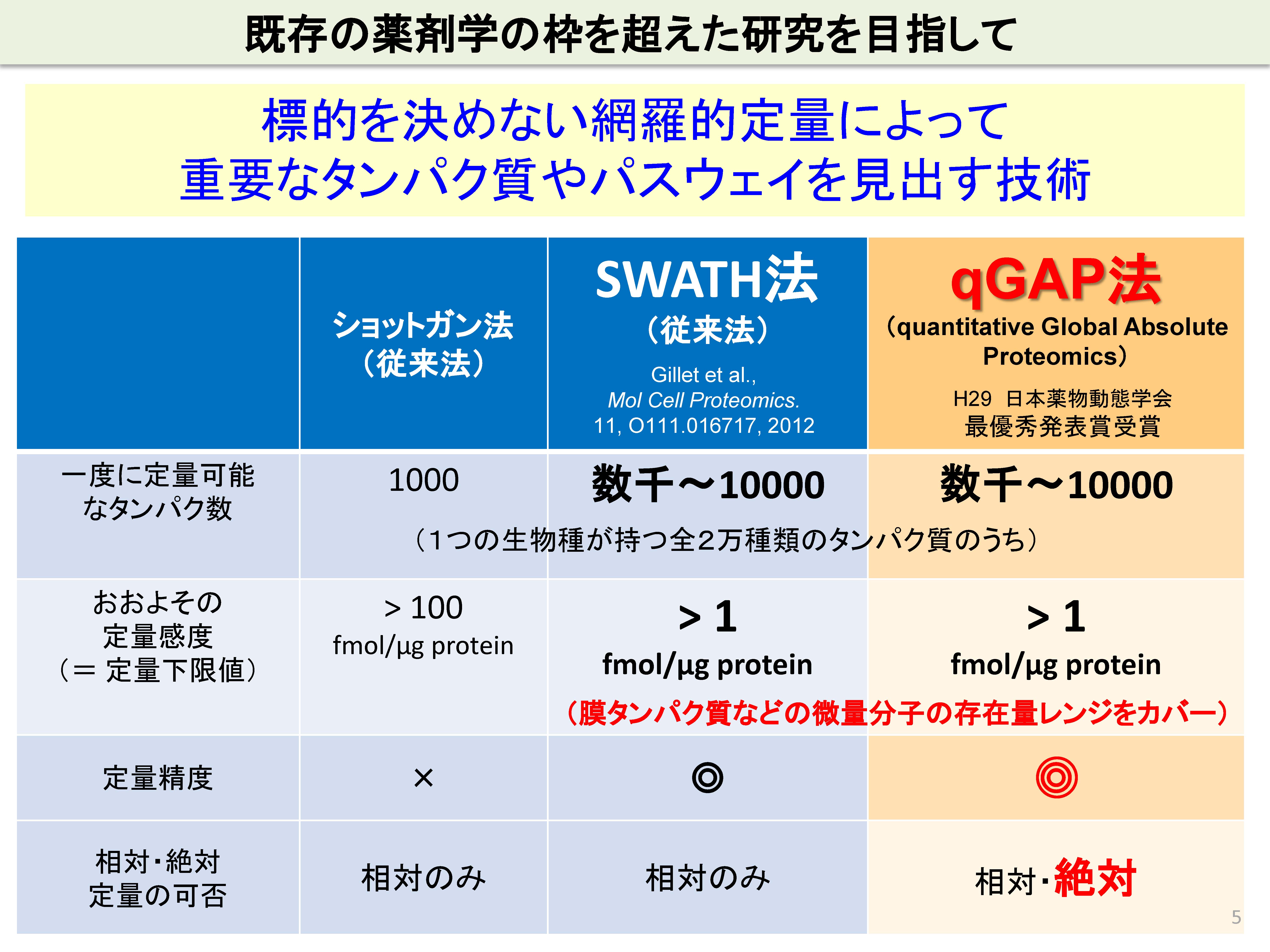
薬効や薬物動態など、既存の分子では説明できない現象がたくさんあります。従来の既存の分子に焦点を当てる研究では薬学研究の突破口を拓くことはできないと考えられます。未解明の分子機構を解明するための有望な技術として、我々は、網羅的定量プロテオミクス法(網羅的にタンパク質分子を探索し、定量する技術)を用いています。
当研究室で用いている方法の一つであるSWATH法は、従来型のショットガン法に比べて、定量精度が飛躍的に改善し、さらにより少ないタンパク質まで定量することができる技術です。結果として、より多くの種類のタンパク質を高い精度で定量することができます。我々は、独自に、SWATH法を改良し、quantitative Global Absolute Proteomics (qGAP法)を開発しました。通常の網羅的プロテオミクス法は、2群間や複数群間での相対定量(個々のタンパク質の存在量が、ある群に比べて他の群で何倍異なるかを定量する方法)が主流です。qGAP法は、この相対定量に加えて、個々のタンパク質の絶対存在量(mole)を測定することができる点で優れています。
創薬では、病態の組織や細胞においてどのタンパク質やパスウェイが最も有望な創薬標的分子になるかを考えることが重要であり、タンパク質の存在量が大きいほど有望である場合があります。また、薬物動態の観点では、例えば、中枢の関門で高発現するトランスポーターを同定できれば、中枢組織へ薬物を効率よく届けるルートが開かれます。これらの目的に限らず、網羅的に絶対存在量を決めることができる技術は、あらゆるライフサイエンス研究の場において有用であると考えています。
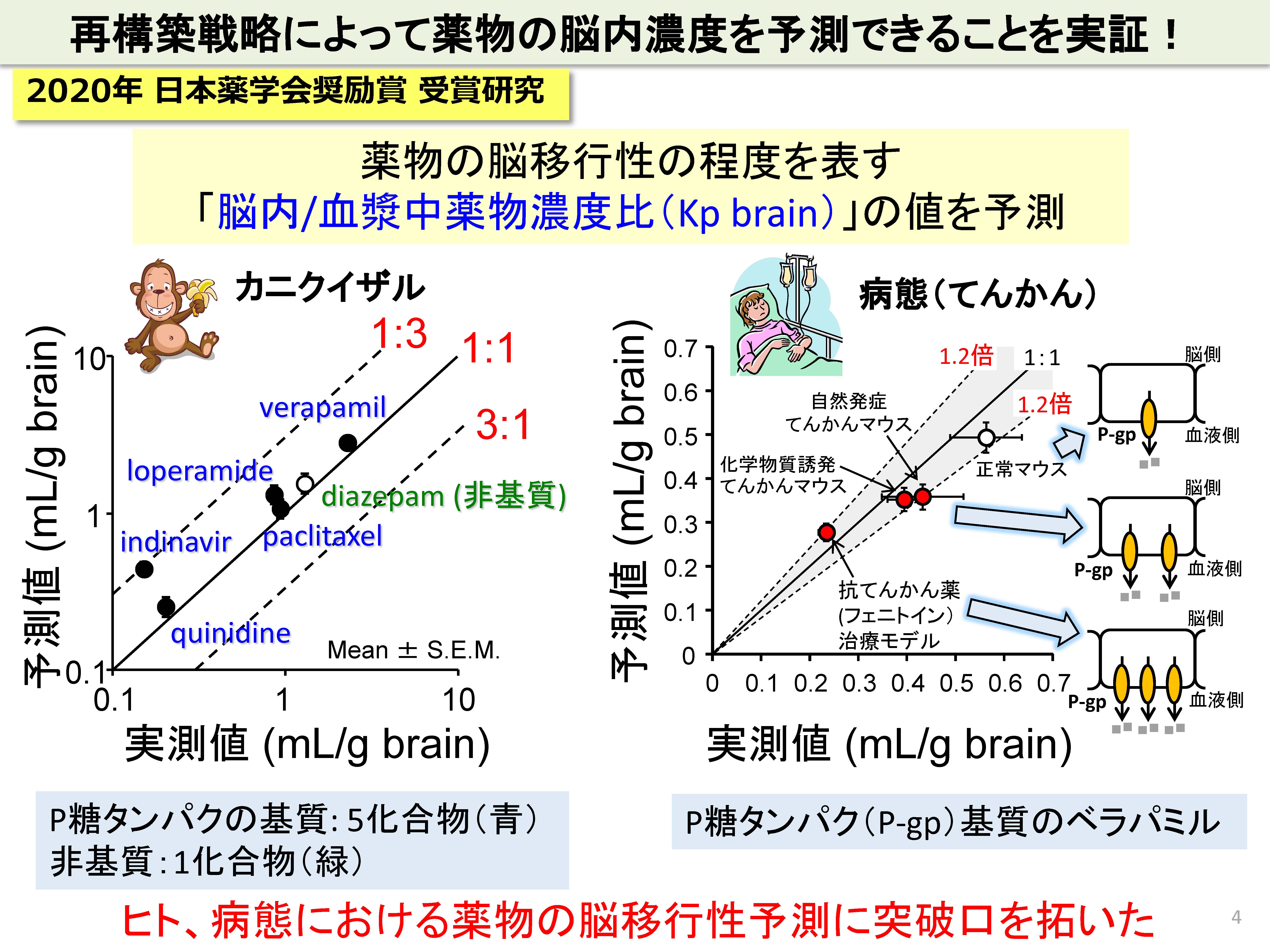
我々は、ヒトの脳への薬物移行性を定量的に正確に予測する手法を開発しました。
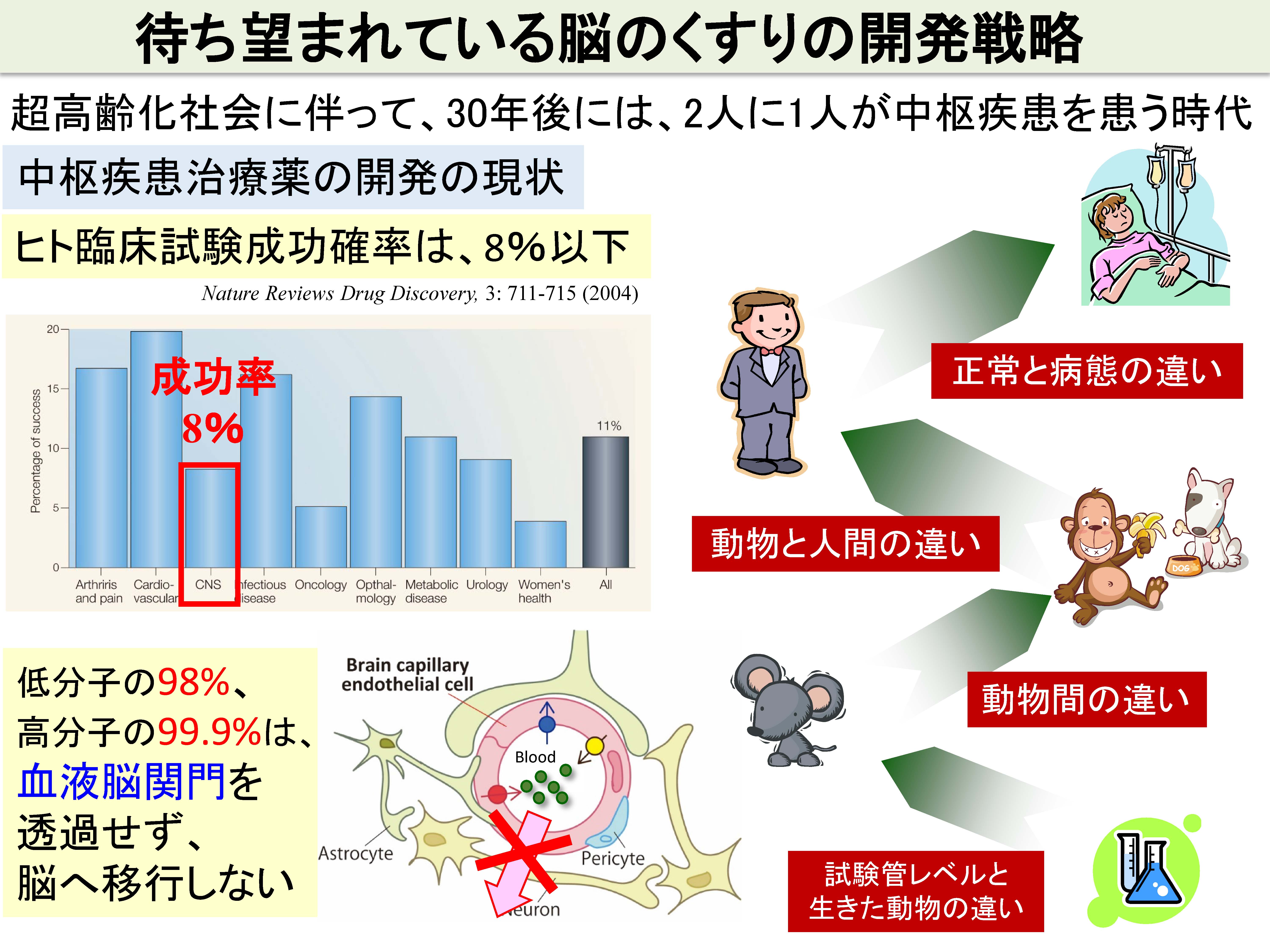
中枢疾患治療薬のヒト臨床試験における成功確率は、依然として非常に低いです。前臨床試験(実験動物)を通過した候補品の多くが、ヒトでの臨床試験で失敗することを意味しています。その主要な要因の一つが、候補品が、ヒトの血液脳関門を通過しない、あるいは通過しすぎて副作用を生じることがあげられます。我々は、標的絶対定量プロテオミクス(quantitative Targeted Absolute Proteomics, qTAP法)を用いて、ヒトと実験動物の間では、血液脳関門のトランスポーターや受容体分子のタンパク質絶対発現量に大きな違いがあることを見出し、実験動物とヒトの薬物脳移行性の種差の原因を解明してきました。例えば、げっ歯類では、P糖タンパク(P-gp)が最も高発現しており、薬物の脳への移行性を制限していますが、ヒトでは、P-gpよりも、Breast Cancer Resistance Protein(BCRP)という別の排出トランスポーターが高発現していることを明らかにしています。従って、新薬開発において、げっ歯類で得られた薬物脳移行性のデータは、必ずしもヒトの脳移行性予測に適用できないことがわかりました。
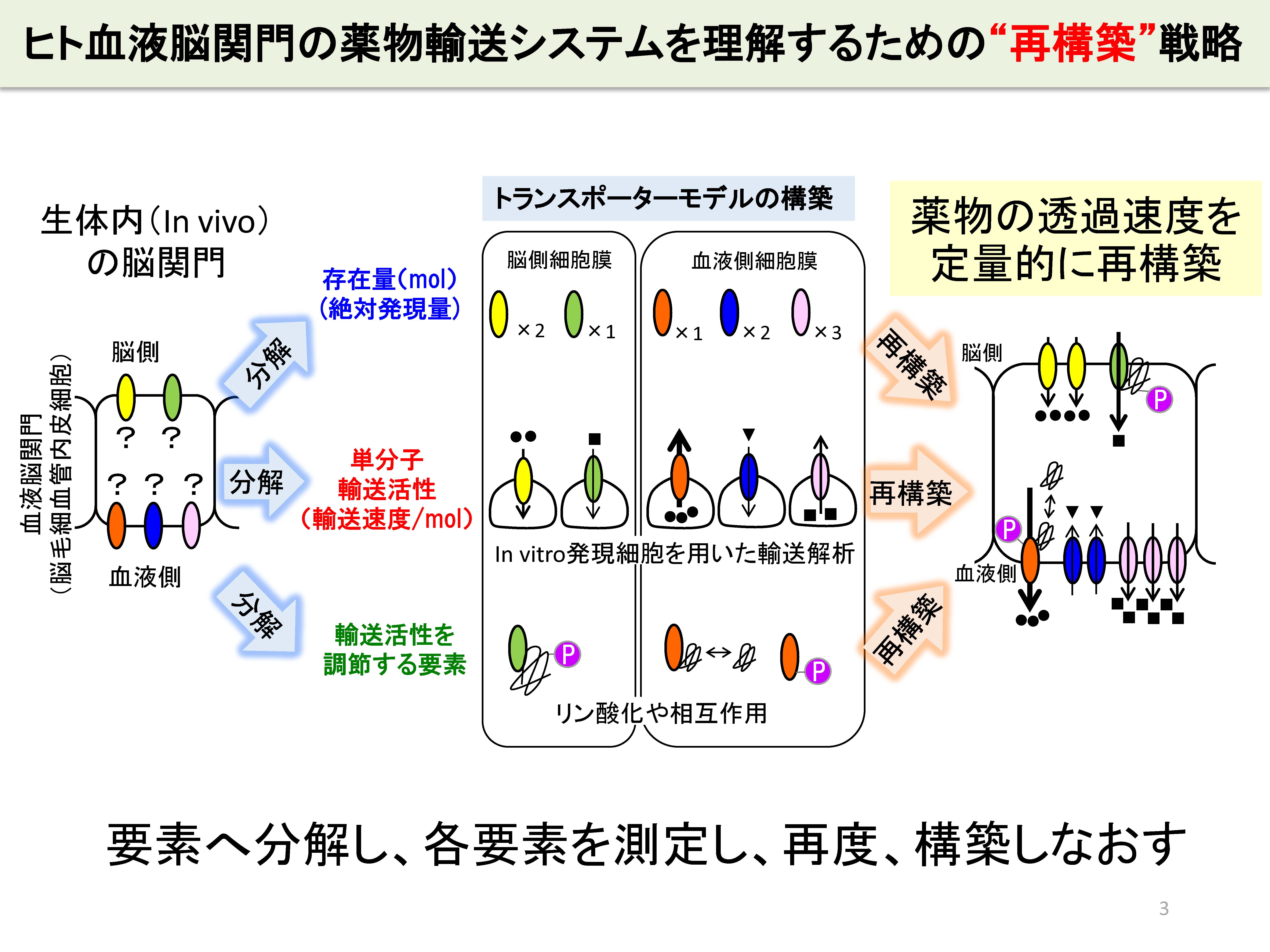
そこで、我々は、ヒトの薬物脳移行性を予測するために、ヒト血液脳関門の輸送システムを要素に分解し、各要素を実験で測定し、再度、構築しなおすことによって理解する戦略をとっています。この「再構築」戦略によって、P-gpに輸送される基質薬物の脳移行性を正確に予測できることを実証しています。特に、ヒトに類似しているカニクイザルで実証できたこと、さらに病態時でも実証できたことから、ヒト、病態における薬物の脳移行性予測に突破口を拓くことができました。
研究内容(~2019): 過去
脳の病気を治す薬を作るには、血液脳関門と血液脳脊髄液関門の働きを知っておく必要があります。
脳には血液脳関門 (Blood-brain barrier, BBB)と血液脳脊髄液関門(Blood-cerebrospinal fluid barrier, BCSFB)が存在し、循環血液と脳内の物質の輸送を厳密に制御しています。BBBの実体は図1のように脳毛細血管内皮細胞です。また、BCSFBは脳室にある脈絡叢上皮細胞がその実体です。いずれも細胞同士が密着結合で連結しているため、細胞間隙を介した物質の透過性はほとんどありません。血液中に到達した薬物が脳実質細胞へ移行して作用を発現するには、BBBを通って脳内へ運ばれる必要があります。BBBには血液中のグルコースやアミノ酸などを脳内へ供給する働きがあることは、良く知られています。比較的最近、この働きは各々GLUT1, LAT1という輸送担体によることが分かりました。毒性の強い薬や農薬などが簡単に脳内へ運ばれるようなことがあっては、脳が正常に働かなくなります。BBBには、ある種の薬物を脳内へ移行しないような働きがあることが分かってきました。制癌剤を繰り返し投与すると薬が効きにくくなることが古くから知られていますが、これと同じメカニズムが正常なBBBにも備わっています。細胞内あるいは細胞膜に溶けた薬物を、P-糖蛋白(MDR1,P-gp)と呼ぶ輸送担体が、ATPの加水分解エネルギーを直接消費して、細胞外に排出します。BBBが薬を脳内へ通しにくくしている仕組みの一つは、このP-gpによります。
BBB、BCSFBの働きを明らかにするには、良い培養細胞株を作ることが大切です。
私達の研究室では、このBBB, BCSFBの輸送機能を明らかにして、どうしたら効率良く薬物を脳内へ移行させることができるか?その方法を探ることを究極の目標としています。図1に示すように、脳毛細血管内皮細胞は脳のわずか0.1%を占めるに過ぎません。また、脈絡叢上皮細胞も髪の毛1本くらいの大きさです。こんなに僅かな量では、蛋白や遺伝子解析だけでなくその働きを調べることも困難です。BBB, BCSFBの働きを明らかにするには、各々の細胞を大量に増やすことが成功の鍵を握ります。世界中の大学や製薬企業の研究者が、過去20年間、よりよいin vitro実験方法を作ろうと取り組んできました。単離脳毛細血管は、細胞が障害を受けておりATPを大量に消費する輸送機能解析には使えません。初代培養脳毛細血管内皮細胞は、グルコース輸送系を例に挙げると、その働きがin vivoに比べて100分の1程度です。これは試験管レベルにしたときに、本来の遺伝子・蛋白の発現が、何らかの原因で低下するためです。不死化細胞株も、初代培養細胞と同様、in vivoに比べて極めて低い特性を有しています。場合によっては、in vivoでは発現していない遺伝子が発現することがあります。これまでは、これらの問題を理解した上で、実験結果が解釈されてきました。実験手法の限界は、研究の発展性の障害となっていました。優れたin vitro実験系を開発することが、この領域の研究を大きく発展させる鍵を握ると考えました。
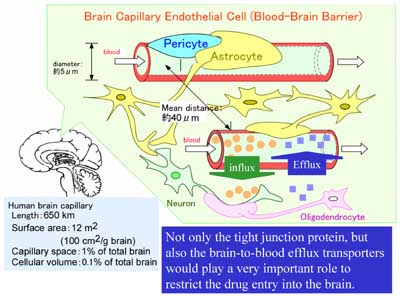
図1.血液脳関門(BBB)の構造
脳毛細血管内皮細胞の条件的不死化細胞株は、in vivoに限りなく近い特性を持つ優れたin vitro実験系であることが分かりました。
私達は、本学加齢医学研究所帯刀益夫教授とYS研究所上田正次博士との共同研究で、図2の原理にしたがって、脳毛細血管内皮細胞の条件的不死化細胞株を樹立しました。これは、温度が33度で活性型となるSV40 large T抗原の遺伝子を導入したラットやマウスから不死化細胞株を樹立するものです。この抗原蛋白は、体温ではほとんど活性を示さないことから、比較的若いラットやマウスでは正常動物となんら差はありません。一方、33度では活性型構造になるために、組織を摘出して33度に保つと、ある確率で細胞が不死化の引き金をひくことになります。従来法(図2Traditional Method)では、不死化遺伝子を導入しても、染色体のどこに入っているか個々の細胞で調べることは困難でした。また、不死化遺伝子の導入段階で細胞が障害を持っているか全く不明でした。さらに、従来法では、遺伝子が導入できた細胞を薬剤耐性などの手法でスクリーニングする必要があり、とても大きな負荷をかけてわずかに生き残った細胞を利用するというものでした。一方、私達が用いた(図2Transgenic animal method)方法では、全ての細胞にあらかじめ不死化遺伝子が導入されており、従来法よりもはるかに簡単に不死化ができるだけでなく、組織をバラバラにする酵素処理も極めてマイルドな条件下で行うことが可能であり、微量組織からの不死化細胞株の樹立が可能です。細胞は培養温度を33度にするだけで不死化の引き金が引かれるために、特別なストレスをかけることなく不死化することができました。
樹立した細胞株がどれくらいin vivoの働きを反映しているか?これはとても重要な点です。図3の横軸は、この細胞を用いて測定した種々の基質の輸送活性を1グラムの脳が100cm2の表面積の脳毛細血管内皮細胞をもっていると換算したものです。図3の縦軸は私達の研究室でin vivo系を用いて実測した値、あるいは他の研究室で測定した報告値です。図3の縦軸と横軸は同じ単位の絶対値で比較したものです。グルコースの輸送活性は、まだ、in vivoに比べて7分の1ですが、これでも従来の初代培養細胞に比べると飛躍的な進歩です。図3に示すように、他の輸送系を介するものについては、絶対値で比較してほぼ同程度です。つまり、樹立した細胞はかなりin vivoの特性を反映していることが分かりました。恐らく、細胞を不死化する過程が従来法に比べてかなりマイルドな条件で行っていることが成功した原因ではないかと考えています。
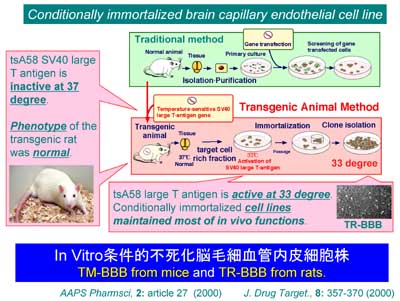
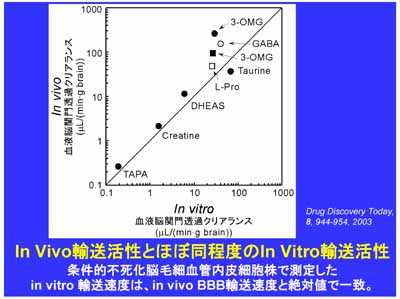
図2.条件的不死化細胞株の樹立方法
この原理にしたがって、種々の関門組織を構成する細胞の条件的不死化細胞株が樹立できました。
人の身体にはBBBやBCSFBの他に、血液網膜関門や血液胎盤関門などによって、栄養物質が供給されたり、薬物の移行性を制限されている組織があります。条件的不死化細胞株樹立法の長所の一つは、微量な組織から細胞株を樹立できる点です。共立薬科大学薬剤学教室の中島恵美教授らのグループと富山医科薬科大学薬剤学教室の細谷健一教授らのグループとの共同研究によって、脳毛細血管周皮細胞(現在、当研究室の研究員・浅嶋朋子博士の業績)、胎盤関門細胞(共立薬科大学博士課程・北野智英修士の業績)、網膜毛細血管ミューラー皮細胞(現在、富山医科薬科大学薬剤学教室助手・登美斉俊博士の業績)など多くの細胞株が樹立されました。図4は、これらの樹立細胞株の種類とコード番号をまとめまたものです。
>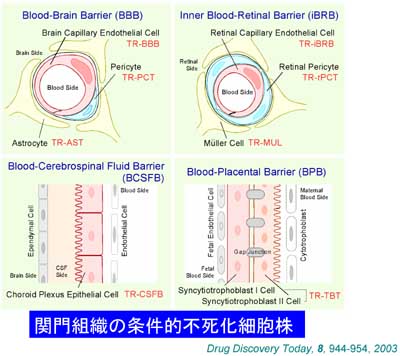
図4.関門組織の条件的不死化細胞株
遺伝的背景などの要因を統一した条件的不死化細胞株との共培養系は、細胞間相互作用機構の研究を大きく発展させる有力なツールとして期待できます。
BBBの構造と機能は、古くから、脳毛細血管内皮細胞(endothelial cell)と周皮細胞(pericyte)と星状膠細胞(astrocyte)の相互作用によって形成・維持されていると言われてきました。しかし、どのような分泌蛋白や受容体などによっているのか? 相互作用の実体はまだ、ほとんど解明されていません。脳毛細血管内皮細胞の輸送担体や密着結合蛋白の発現が、星状膠細胞や周皮細胞によってどのように変動するのか?これはBBBの本質にかかわる重要な課題です。私達は、週齢、性、コロニーなどを揃えたラットからこの3者の細胞株を樹立しました(図4)。その目的は、これらの細胞間の相互作用の分子機構を解明するためです。
最近、当研究室の堀里子助手らは、脳毛細血管内皮細胞の密着蛋白の一つであるoccludinの発現誘導機構の一部を明らかにしましました(図5)。周皮細胞からangiopoietin-1が分泌され、内皮細胞のTie2受容体のリン酸化を促進してoccludinのmRNAを増加させ、occludin蛋白を増やすというものです。また、脳毛細血管内皮細胞に発現するBCRP/ABCG2というABC transporterの一種の発現が、星状膠細胞からの分泌因子によって誘導されることも分かりました。
核内受容体などの関与による輸送担体の発現制御機構は、薬物相互作用の予測などとの関連から重要な課題です。BBBの核内受容体の発現と働きについて、これらの細胞株を用いて研究を開始しました。図6に示すように条件的不死化細胞株は種々の研究への応用が期待されます。
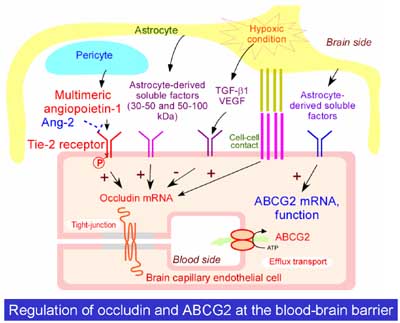
図5.脳毛細血管内皮細胞におけるトランスポーター、密着結合蛋白の制御
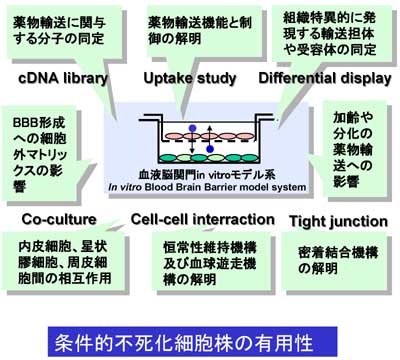
図6.条件的不死化細胞株の有用性
BBBは、脳内エネルギー緩衝系の一部として重要なクレアチンを脳内に供給することが分かりました。
脳内エネルギー源であるグルコースはBBBを通じて血液から供給されることが知られています。一方、エネルギー伝達物質であるATPはわずか数十秒分のエネルギーしかまかなうことができません。エネルギー供給の停止が一瞬たりとも許されない脳神経細胞にはエネルギーを一時的に溜めるシステムが必要です。クレアチンリン酸はこのシステムの鍵を握る物質であり、脳内は血液中の200倍も高濃度に保たれています。
BBBには血液中のクレアチンを脳内へ運ぶ輸送系があることが分かりました。この輸送担体のKm値は17uMです。ヒトの血液中のクレアチン濃度は50uMですから、約75%の輸送担体は飽和しています。つまり、クレアチンを経口摂取した場合、脳内濃度を25%増加させることができる可能性があります。一方、マウスの血中クレアチン濃度は270uMですから輸送担体の95%が飽和しています。クレアチンを投与しても脳内濃度はほとんど増加しないと予測され、マウスではクレアチン投与の効果は期待できません。クレアチンは神経保護効果があると報告されていますので、とても大切な働きをBBBが持っていることになります。マウスの実験で効果がでなくても、もしかしたら、人で効果が期待できるかもしれません。
クレアチンは脳内でも合成されることはこれまで知られていたことです。しかし、脳内のどの細胞が合成できるのか不明でした。最近、北海道大学大学院医学研究科教授渡辺雅彦先生らとの共同研究で、このクレアチン合成酵素GAMTが、星状膠細胞やオリゴデンドロサイト、嗅神経被覆グリアなどに豊富に存在し、神経細胞ではほとんど合成されないことを見出しました。一方、クレアチンリン酸を利用する酵素は神経細胞に多く含まれることが分かりました。血液側から投与した外因的なクレアチンの脳と血液の濃度比は、本来の内因性クレアチンの脳と血液の濃度比と、24時間後には一致しました。つまり、大部分の脳内クレアチンはBBBから供給されていると考えられます。しかし、BBBのクレアチン供給速度は非常に遅いために、神経細胞が急に大量にクレアチンを消費した場合には、間に合わなくなる可能性があります。グリア細胞などでクレアチンを合成する仕組みを脳が持っている理由は、もしかしたら、この時のためにあるのかもしれません。
これら一連の脳内のクレアチンの供給、合成、利用に関する研究は、博士課程3年生(2004年9月現在)の立川正憲君の学位論文研究の一部です。この研究業績がグリア細胞研究会で高く評価され、立川君は、2004年2月に「グリアクラブ賞」を受賞しました(本HPの受賞等の項参照)。
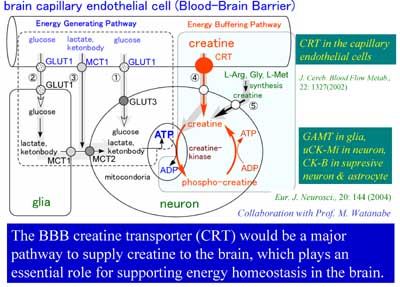
図7.脳関門を介した中枢エネルギー源およびエネルギー貯蔵物質の供給
BBBの生理的役割の本質にかかわる脳から血液方向輸送機構を明らかにするためにBrain Efflux Index法を開発しました。
細胞膜は脂質二重層から構成されることから、一般に脂溶性の高い物質はBBBをより高い速度で透過することが古くから知られています。つまり、血液中の親水性物質はBBBを介して脳内へ移行しにくいことと同じ意味です。それでは、脳内で産生される親水性物質のBBB透過性も低いのでしょうか?これまで漠然とBBBは脳内に神経伝達物質などを保持する役割を果たしていると考えられてきました。しかし、本当にそうなのでしょうか?P-gpはBBBにおいて薬物の脳から血液方向の輸送を担っていることが知られていますが、脳内の内因性の親水性物質の運命はどうなっているのでしょうか?
血液から脳方向のBBB輸送研究は、1960年代にWilliam Oldendorf博士がBrain Uptake Index法を開発したことによって飛躍的に進歩しました。しかし、脳から血液方向のBBB輸送機構を解析するin vivo実験法は開発されていませんでした。1993年頃、BBBには脳から血液方向の輸送過程を仮定するとある種の薬物の脳への移行性が低い原因を説明できることが次第に分かってきました。しかし、その機構を解明する実験方法がありませんでした。当時、東京大学薬学部の杉山教授研究室に在籍していた寺崎は、ある日、大学院の講義の準備中に、Oldendorf博士がBrain Uptake Index法を開発したエピソードを目にしました。このとき、このBrain Uptake Index法と全く逆の原理を利用すれば脳から血液方向のBBB透過機構を解明できるのではないか?という考えが浮かびました。講義を終え、すぐに当時博士課程の学生だった高沢さんと一緒に、この原理を試してみました。3H-waterと14C-イヌリンの混合液を脳内に投与して30分後に測定したところ、14C-イヌリンだけが脳内に残っており、3H-waterは脳には残っていませんでした。その後、研究生の掛江さんも加わり、2年後にBrain Efflux Index (BEI)法(図8)が開発できました。原理は簡単で、BBBを透過しにくい物質と試したい物質の混合液を大脳皮質に投与し、一定時間後の脳内残存率を測定する方法です。このBEI方法をJ. Pharmacol. Exper. Ther., に投稿したところ、truly innovative methodと審査員からコメントをいただき感激した記憶があります。
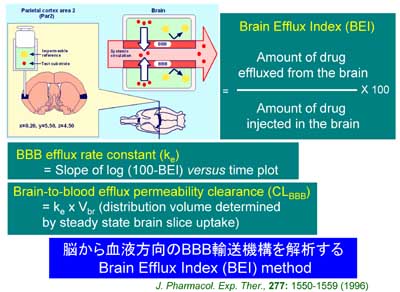
図8.脳から血液方向の脳関門輸送機構を解析するBrain Efflux Index法
BBBは、脳内で作られる神経伝達物質・神経調節因子・神経伝達物質の代謝物を脳から排出することが分かりました。
その後、多くの大学院生の協力を得て、このBEI法を利用して脳から血液方向の多くのBBB排出輸送機能とメカニズムを明らかにすることができました。もちろん、BEI法だけでは輸送担体の分子機構まで明らかにすることは困難ですので、条件的不死化細胞株を用いた遺伝子・蛋白・輸送活性などの解析、免疫組織化学的手法を用いた輸送担体の局在解析、などを駆使する必要がありました。幸い、大槻純男助教授は分子生物学と遺伝学の手法と共に、これらの多くの手法を導入して、BBBは脳から血液方向に多くの異なる輸送系が働いていることを明らかにしました。図9は、これらの成果をまとめたものです。赤色の○で囲んだものは私達の研究室で初めてBBBで働いていることを見出したもので、緑色の○で囲んだものは、他の研究室でも研究が進んでいたものを、私達の研究室で、その働きを詳細に検討したものです。これらの研究によって、BBBは脳内で作られる神経伝達物質・神経調節因子・神経伝達物質の代謝物を脳から血液方向に輸送する働きをもっていることが分かりました。
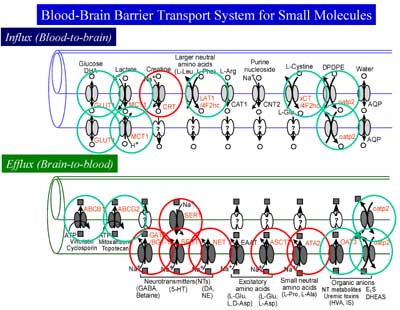
図9.血液脳関門に発現するトランスポーター
神経変性疾患とBBBの働きの関係を明らかにすることは、疾患の原因解明と治療方法の開発の面から、大変、興味深い重要な課題です。
脳内で作られる親水性物質がBBBによって脳から血液方向に排出されるのであれば、より大きな分子量の蛋白質はどうなのでしょうか?最近、W.M.Pardridge博士らは、BEI法を利用してIgGやトランスフェリンが脳から血液方向に排出されることを明らかにしました。いずれも受動拡散では細胞膜を透過することができない物質で、受容体が関与していると考えられています。一方、脳内には蓄積すると神経障害を起こす物質が種々、知られています。BBBは、これらの脳内蓄積物質を脳内に保持する役割を持っているのでしょうか?あるいは脳から血液方向へ排出する役割があるのでしょうか?最も有名な神経変性疾患の一つとしてアルツハイマー病が知られています。これは脳内に42個のアミノ酸で構成されるアミロイド蛋白という物質が蓄積する病気です。この蛋白の球状のオリゴマーが神経細胞毒性を引き起こす原因物質であると報告されています。カナダのグループは、P-gpがこのアミロイド蛋白を運ぶ可能性があると主張しています。BBBには、P-gpが発現していますので、これはとても興味深い仮説です。一方、アメリカのグループはLRP-1という受容体がBBBで働いて脳から血液方向にアミロイド蛋白を輸送していると主張しています。これも大変、興味深い報告です。BBBの生理的役割を知るだけでなく、アルツハイマー病の根本的治療法開発に新しい道を見出す可能性があります。私達の研究室でも、これらの研究に多くの関心を寄せています。低分子量物質だけでなく、より大きな分子量の蛋白がBBBによって脳から血液方向へ排出されるのか否か?もし、そのような排出輸送機構が存在するのであれば、その働きを活性化することで、これらの蛋白を脳内に蓄積しにくくすることは可能でしょうか?アルツハイマー病を始めとする神経変性疾患とBBBの関係は、ほとんど未知の研究領域です。BBBを標的とした創薬という点でも、今後の重要な研究課題の一つと考えています。
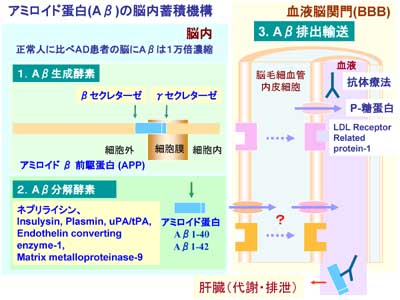
図10.βアミロイド脳内蓄積と血液脳関門排出輸送
BBBの生理的役割を明らかにすることは、効率よく脳内へ到達する薬をデザインする上で大切な課題です。さらに、神経変性疾患とBBBの関係を明らかにすることは、BBBをターゲットとした新しい創薬のシーズが生まれる可能性があります。
私達の研究室は、BBBの生理的役割を明らかにすることで、どうしたら脳への移行性に優れた薬物を開発できるかという課題に向かってチャレンジし続けたいと考えています(図11)。生理学的な興味に終始することなく、得られた成果を創薬の方向へ生かしていきたいと考えています。
思考錯誤によってBBBを透過する物質を見つけられる確率は5%以下と言われています。末梢組織を標的とした薬の開発に比べて、脳の薬は20倍以上も開発が困難です。BBBの排出輸送機能の全容を明らかにすることで、どうしたら脳から排出されにくい薬を作ることができるか?多くの研究課題が残されていますが、私達が開発したBEI法と条件的不死化細胞株を用いることで、今後、益々、BBBの働きを明らかになっていくと確信しています。
一方、蛋白質のBBB透過機構に関する研究は、始まったばかりです。疾患との関係もこれから多くの研究課題が残されています。一人でも多くの若くて情熱に溢れる優れた研究者がこの領域に参入し、これらの重要な課題に取り組んで、飛躍的に発展させることを祈念しています。
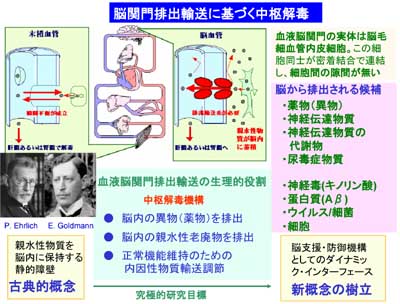
図11.脳関門排出輸送に基づく中枢解毒
血液組織関門研究の基盤を広げるため、樹立した細胞株は大学などの研究室に供与し、国際共同研究を実施しています。
細胞株樹立論文は、当初の評価は低く、いわゆるimpact factorの高い雑誌には受理されませんでした。しかし、論文発表と同時に、多くの研究者からの細胞供与の問い合わせがありました。私達の研究テーマと同じ場合を除き、原則として共同研究という形で細胞を供与することで関連領域の活性化に努めようと考えています。図12に示すように、2004年8月現在で、その数は、世界10カ国40箇所を数えています。また、国際共同研究の成果は、国際学会での発表だけでなく、論文発表まで発展しております。従来、牛大脳毛細血管内皮細胞の初代培養系を用いて研究が進んできましたが、狂牛病の影響もあり、in vitro系での実験はかなり制限があると思います。興味をお持ちの方は、ぜひ、寺崎哲也宛、メールでご連絡ください(terasaki@mail.pharm.tohoku.ac.jp)。
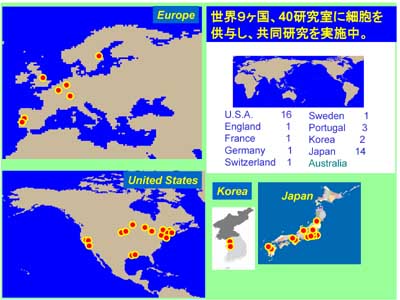
図12.条件的不死化細胞の供与先
企業の研究者の方で私達の細胞株に興味をお持ちの場合、試験的に使っていただくことができます。
新薬の探索研究や開発研究に私達の細胞株をお使いいただくことができます。これまでもいくつか問い合わせがありましたが、多くの方が「どこまで使えるか分からない?」とおっしゃいます。そこで、試験的に使っていただいて、各々の方の目的に適うようでしたら、本格的に導入していただくという方法も準備しております。寺崎までメールで直接お問い合わせいただきますようお願いいたします。
細胞株に関するより詳細な情報は、下記の総説をご覧ください。その他、細胞株の特性に関するご質問は、寺崎哲也宛にメールでお寄せください。
1. T. Terasaki, S. Ohtsuki, S. Hori, H. Takanaga, E. Nakashima, K. Hosoya,New approaches to in vitro models of blood-brain barrier drug transport. Drug Discovery Today, 8: 944-954 (2003)
2. T. Terasaki and K. Hosoya, Conditionally immortalized cell lines as a new in vitro model for the study of barrier functions.Biol. Pharm. Bull., 24: 111-118 (2001).
3. K. Hosoya, S. Ohtsuki, T. Terasaki, Recent advances in the brain-to-blood efflux transport across the blood-brain barrier, Int. J. Pharm., 248: 15-29 (2002).
4. 寺崎哲也、堀 里子、大槻純男, 「特集号:細胞を用いた治療・創薬・DDS研究の最前線(編集、帯刀益夫、寺崎哲也)」条件的不死化脳関門細胞株を用いた脳へのDDS研究の新展, Drug Delivery System, 18: 118-125 (2003)